时间:2017-08-10 02:48:28
1、选择题 右图为周期表中短周期的一部分,若a原子的最外层上有5个电子,则下列说法中不正确的是( )
A.d单质可跟b的氢化物的水溶液反应
B.原子半径a>b>c
C.b的氢化物比a的氢化物稳定
D.a的最高价氧 化物的水化物比b的最高价氧化物的水化物酸性强
参考答案:D
本题解析:
本题难度:简单
2、选择题 化学科学研究需要借助化学用语描述.下列化学用语正确的是( )
A.乙烯的结构简式:CH2CH2
B.溴乙烷的电子式为: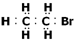
C.乙炔分子的球棍模型:
D.HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+
参考答案:A.乙烯的结构简式为CH2=CH2,故A错误;
B.溴乙烷的电子式为: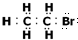 ,故B错误;
,故B错误;
C.乙炔是直线形分子,碳碳原子之间存在三键,所以其球棍模型: ,故C正确;
,故C正确;
D.HCO3-的水解方程式为:HCO3-+H2O?H2CO3+OH-,故D错误;
故选C.
本题解析:
本题难度:简单
3、选择题 下列过程中,共价键被破坏的是
[? ]
参考答案:D
本题解析:
本题难度:简单
4、选择题 短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
| X Y Z |
参考答案:D
本题解析:
本题难度:简单
5、填空题 (1)三聚氰胺(结构如右图),由于其含氮量高被不法奶农添加到牛奶中 来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。?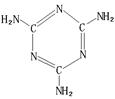
三聚氰胺中C原子的杂化形式是??
二种环境的N原子的杂化形式分别是?,?。
(2)化合A是一种不稳定的物质,它的分子式可表示为OxFy,10mL A气体能分解成为15mL O2和10mL F2(同温同压)
①A的分子式是?;
②已知A的分子中的x个氧原子呈…O-O-O…链状排列,则A的电子式是?,A分子的结构式是?。
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++x R-H→Rx[CrCln(H2O)6-n]+xH+
交换出来的H+经测定,即可求出x和n,确定配离子的组成。
将含0.0015mol [CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol/L NaOH溶液25.00ml,推知:
x=?,n=?,?该配离子的化学式为?。
参考答案:(1) sp2? sp2? sp3(每空1分)
(2) ①F2O3(1分) ② 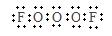 ?F-O-O-O-F?(每空2分)
?F-O-O-O-F?(每空2分)
(3)? 2? ?1?(每空1分)?[CrCl (H2O)5]2+ ?(2分)
?1?(每空1分)?[CrCl (H2O)5]2+ ?(2分)
本题解析:略
本题难度:简单