时间:2017-08-10 02:45:09
1、实验题 用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.1mol/L的溶液100mL
②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察观象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是______________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH________1(选填>、<、=) 乙方案中,说明HA是弱电解质的现象是________(多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快,
(3)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
________________________________
参考答案:(1)100mL容量瓶
(2)>;b
(3)配制NaA溶液,测其pH值>7即证明HA是弱电解质
本题解析:
本题难度:一般
2、填空题 下列实验操作或叙述正确的是___________(填序号)
A.乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇
B.将无水乙醇和浓硫酸按体积比3∶1混合,加热至140℃制取乙烯
C.蔗糖水解用浓硫酸作催化剂
D.在鸡蛋白溶液中加入浓HNO3,微热后会生成黄色物质
E.油脂皂化反应后,反应混合物中加入食盐可将肥皂分离出来
F.植物油和裂化汽油可用溴水鉴别
参考答案:ADE
本题解析:略
本题难度:简单
3、简答题 图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置.其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉.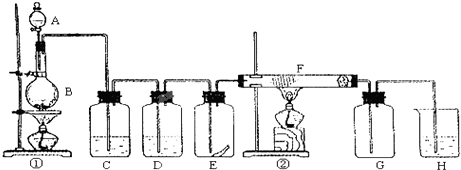
试回答:
(1)A试剂为______,B试剂为______,化学方程式为______;
(2)C试剂为______;D试剂作用为______;
(3)E中干燥红色布条______(填“褪色”或“不褪色”);
(4)F管中现象______;
(5)H中化学方程式为______.
参考答案:根据题中所给出的信息可知本实验是室制取纯净、干燥的Cl2,并进行检验Cl2性质实验.
(1)依据课本所学制备氯气用的是浓盐酸和固体MnO2的加热反应.所以A为浓盐酸,B为MnO2,反应的化学方程式为:MnO2+4HCl-?△?.?MnCl2+Cl2↑+2H2O,
故答案为:浓盐酸;MnO2;MnO2+4HCl-?△?.?MnCl2+Cl2↑+2H2O;
(2)由①中生成氯气,氯气通到C中出去挥发出的HCl气体,除去HCl气体有饱和食盐水,因此C为饱和食盐水;氯气从C中通入到D中进行干燥出去氯气的水蒸气,D中是浓硫酸,
故答案为:饱和食盐水;吸水氯气中的水蒸气;
(3)氯气从D中出来后是干燥的氯气,通到E中,干燥的氯气不能漂白,因此E中的干燥布条不褪色,故答案为:不褪色;
(4)已知F中是铜网,在加热的条件下,氯气与Cu发生反应,生成棕黄色的烟.脱脂棉的作用是为了防止防止CuCl2固体小颗粒被气体鼓入导管中,堵塞导管,影响氯气的收集,
故答案为:棕黄色的烟;
(5)氯气是有毒气体,所以H中是吸收多余气体的NaOH溶液,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
本题解析:
本题难度:一般
4、实验题 ( 11分)乙醇的沸点是78℃,能与水以任意比混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制醚的反应原理是:
2CH3CH2OH?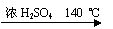 H2O + CH3CH2—O—CH2CH3 (乙醚)
H2O + CH3CH2—O—CH2CH3 (乙醚)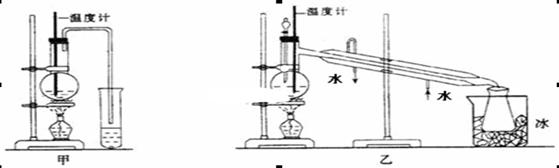
(1)甲图和乙图是两套实验室制乙醚的装置,选装置_______(填“甲”或“乙”)最合理,理由是_____________。
(2)反应液中应加入沸石,其作用是____________。
(3)反应中温度计的正确位置是水银球置于________________________。
(4)用上述装置乙制得的乙醚中可能含有大量的杂质,该杂质是__________,除去这种杂质的简易方法是________________________________。
(5)如果温度太高(如170℃),将会发生一个有机副反应,反应方程式为:____________________________________________。
参考答案:(1)乙(1分),?冷却效果好(乙醚远离火源)(1分)?(2)防止暴沸(1分)
(3)反应物的液面下,但不能触及瓶底(2分)
(4)乙醇 (1分)?将其与饱和 Na2CO3混合,然后静置分液(2分)
(5)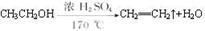 (3分)
(3分)
本题解析:(1)通过题给信息知,乙醚的沸点为34.6℃,易挥发,易燃烧,则制取乙醚应有冷凝装置(防止乙醚挥发),收集装置不能离火源太近,否则会有危险,应选乙装置,原因是冷却效果好,乙醚远离火源;(2)反应液中应加入沸石,其作用是防止暴沸;(3)温度计测量的是混合液的温度,(3)反应中温度计的正确位置是水银球置于反应物液面以下,但不能触及瓶底;(4)由于乙醇的沸点78℃,随着反应温度的提高会有较多的乙醇挥发出来,根据题给信息知,可用用Na2CO3溶液将乙醚与乙醇分离,操作是将其与饱和Na2CO3溶液混合,静置分液;(5)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为: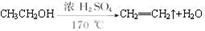 。
。
本题难度:一般
5、实验题 实验室需要纯净的NaCl溶液,但实验室的NaCl晶体混有少量Na2SO4和NH4HCO3,某同学按如下流程图设计实验除去杂质,回答下列问题: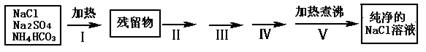
(1)步骤I除去的杂质是(填化学式)_______________,直接加热要好于加强碱后再进行加热,理由是?;
(2)按流程图完成实验设计,将相关的实验操作、实验现象和实验目的填写在下表中:
| 操作步骤 | 实验现象 | 实验目的 |
| 步骤II:将残留物溶解得到溶液,? | ? | ? |
| 步骤III:? ? |  | ? |
| 步骤IV:过滤,往滤液中? ? | ? | ? |
| 步骤V:将溶液加热煮沸 |  | ? |
参考答案:(17分)
(1)NH4HCO3(2分)
操作简单;节省试剂;不引入新的杂质(2分,答其中两点可得满分)
(2)(共10分,除注明外每空1分,着重号为给分点)
操作步骤
实验现象
实验目的
步骤II:往溶液中滴加过量的BaCl2溶液
生成白色沉淀
除去SO42-离子
步骤III:往悬浊液中(或过滤后,往滤液中)滴加过量的Na2CO3溶液
除去过量的Ba2+离子
步骤IV:滴加适量的盐酸
产生少量气泡
除去过量的CO32-离子

?
驱赶溶解在溶液中的CO2和HCl气体(2分)
?
(3)5.07 (3分)
本题解析:(1)铵盐不稳定,受热易分解,则加热的目的是除去固体混合物中的碳酸氢铵,NH4HCO3 NH3↑+H2O↑+CO2↑;强碱与铵盐容易反应生成盐、氨气和水,除去旧杂质的同时,又引入新杂质,且增大试剂、操作步骤增多;(2)除去碳酸氢铵后,先将所得白色固体溶解,再向溶液中加入过量BaCl2溶液,使硫酸钠完全反应,生成白色的硫酸钡沉淀和NaCl,除去溶液中的硫酸根离子,但是引入的钡离子是新的杂质;为了除去钡离子,应向悬浊液或过滤所得滤液中加入过量碳酸钠溶液,使氯化钡完全与碳酸钠反应,生成白色的碳酸钡沉淀和氯化钠,除去溶液中的钡离子,但是引入的碳酸根离子是新的杂质;过滤,分离出硫酸钡、碳酸钡沉淀之后,为了除去滤液中的碳酸根离子,应向其中加入适量盐酸,碳酸钠与盐酸反应,生成氯化钠、二氧化碳气体和水,除去溶液中的碳酸根离子,但是引入的盐酸是新的杂质;盐酸和水的沸点较低,氯化钠的沸点高,将溶液煮沸,可以除去溶液中的氯化氢、二氧化碳和水,蒸发可得纯净的氯化钠固体;(3)依题意,36.0gNaCl溶于100g水中,即可配制20℃的饱和NaCl溶液;由于溶液的质量等于溶质质量与溶剂质量之和,则36.0gNaCl溶于100g水形成136.0g饱和NaCl溶液;由于溶液体积等于溶液质量与溶液密度的比值,则饱和NaCl溶液的体积为
NH3↑+H2O↑+CO2↑;强碱与铵盐容易反应生成盐、氨气和水,除去旧杂质的同时,又引入新杂质,且增大试剂、操作步骤增多;(2)除去碳酸氢铵后,先将所得白色固体溶解,再向溶液中加入过量BaCl2溶液,使硫酸钠完全反应,生成白色的硫酸钡沉淀和NaCl,除去溶液中的硫酸根离子,但是引入的钡离子是新的杂质;为了除去钡离子,应向悬浊液或过滤所得滤液中加入过量碳酸钠溶液,使氯化钡完全与碳酸钠反应,生成白色的碳酸钡沉淀和氯化钠,除去溶液中的钡离子,但是引入的碳酸根离子是新的杂质;过滤,分离出硫酸钡、碳酸钡沉淀之后,为了除去滤液中的碳酸根离子,应向其中加入适量盐酸,碳酸钠与盐酸反应,生成氯化钠、二氧化碳气体和水,除去溶液中的碳酸根离子,但是引入的盐酸是新的杂质;盐酸和水的沸点较低,氯化钠的沸点高,将溶液煮沸,可以除去溶液中的氯化氢、二氧化碳和水,蒸发可得纯净的氯化钠固体;(3)依题意,36.0gNaCl溶于100g水中,即可配制20℃的饱和NaCl溶液;由于溶液的质量等于溶质质量与溶剂质量之和,则36.0gNaCl溶于100g水形成136.0g饱和NaCl溶液;由于溶液体积等于溶液质量与溶液密度的比值,则饱和NaCl溶液的体积为 =
=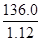 cm3=
cm3=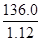 mL;溶质的物质的量等于质量与摩尔质量的比值,则136.0g饱和NaCl溶液中n(NaCl)=
mL;溶质的物质的量等于质量与摩尔质量的比值,则136.0g饱和NaCl溶液中n(NaCl)=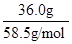 =
=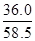 mol;由于c=n/V,则20℃的饱和NaCl溶液的物质的量浓度为
mol;由于c=n/V,则20℃的饱和NaCl溶液的物质的量浓度为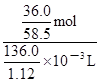 =
=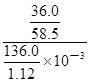 mol/L≈5.07mol/L。
mol/L≈5.07mol/L。
本题难度:一般