时间:2017-08-10 02:44:20
1、选择题 室温时,M(OH)2(S)  M2+(aq)+2OH-(aq) ?Ksp=a,c(M2+)="b" mol·L-1时,溶液的pH等于(?)
M2+(aq)+2OH-(aq) ?Ksp=a,c(M2+)="b" mol·L-1时,溶液的pH等于(?)
A.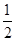 lg(
lg(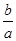 )
)
B.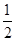 lg(
lg(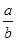 )
)
C.14+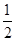 lg(
lg(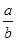 )
)
D.14+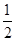 lg(
lg(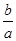 )
)
参考答案:C
本题解析:根据Ksp="a=" c(M2+)·c(OH-)2,c(M2+)="b" mol·L-1,解得c(OH-)2=(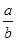 )。本题是碱性环境,先求出c(OH-),根据水的离子积,在求出c(H+),在求出溶液的pH=14+
)。本题是碱性环境,先求出c(OH-),根据水的离子积,在求出c(H+),在求出溶液的pH=14+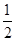 lg(
lg(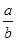 )。
)。
【考点定位】水的离子积、KSP、pH计算
本题难度:简单
2、选择题 把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2++2OH-
Ca2++2OH-
当向悬浊液中加入少量生石灰后,若温度保持不变,下列说法正确的是(?)?
A.溶液中Ca2+数目增多
B.溶液中Ca2+数目不变
C.c(Ca2+)增大
D.c(Ca2+)不变
参考答案:D
本题解析:把Ca(OH)2放入蒸馏水中,达到沉淀溶解平衡后,溶液即是饱和溶液,再加入生石灰,反应消耗水,则原溶液会析出一部分氢氧化钙固体,Ca2+数目减少,但溶液还是饱和溶液,各微粒的浓度不变。故选D
本题难度:一般
3、选择题 下列说法正确的是
A.汽油燃烧时将全部的化学能转化为热能
B.饱和石灰水中加入一定量生石灰,所得溶液的pH增大
C.向AgCl悬浊液中加入KI溶液,白色沉淀转化为黄色沉淀,说明溶解度AgCl<AgI
D.向AgCl悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动
参考答案:D
本题解析:略
本题难度:一般
4、填空题 运用相关原理,回答下列各小题:
Ⅰ.已知NaHSO4在水中的电离方程式为NaHSO4=Na++ H++ SO42- 。
(1)在NaHSO4溶液中c(H+)_________c(OH-)+ c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH___________7(2)将20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为:_________________;向此反应后的溶液中滴加 0.001 mol·L-1BaCl2溶液,首先析出的沉淀是_____________。[KSP(BaSO4)=1.1×10-10mol2·L-2 ;KSP(BaCO3)=5.1×10-9mol2·L-2]
Ⅱ.已知:在25时 H2O H++OH-? KW=10-14 CH3COOH
H++OH-? KW=10-14 CH3COOH H++CH3COO- ?Ka=1.8×10-5
H++CH3COO- ?Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为___________ 。当升高温度时,Kh将___________(填“增大”“减小”“不变”);
(4)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为__________,a与b的关系为________(填“大于”“小于”“等于”);
(5)0.9mol·L-1醋酸钠溶液中[OH-]= mol·L-1 在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,以上三种金属离子中___________能生成沉淀,原因是______________。(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、 KSP[Cd(OH)2]=2.5×10-14、 =2.2)
=2.2)
参考答案:(1)= ; >
(2)CO32-+H+ === HCO3-?; BaSO4
(3)Kh=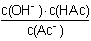 ;增大
;增大
(4)小于;大于
(5)[OH-]=2.2×10-5mol·L-1?Cd2+、Zn2+;
[OH-]=2.2×10-5mol·L-1
[M2+][OH-]2=5×10-12(mol·L-1)
3.5×10-12小于KSP[Mg(OH)2]=1.8×10-11
5×10-12大于KSP[Zn(OH)2]=1.2×10-17
5×10-12大于KSP[Cd(OH)2]=2.5×10-14
本题解析:
本题难度:困难
5、简答题 铬抗腐蚀性高,在钢中含量达到12%称为不锈钢.工业上冶炼铬的主要步骤如图所示:
试回答下列问题
(1)已如步骤Ⅱ的反应方程式为:
8Na2CrO4+6Na2S+23H2O→8Cr(OH)3↓十3Na2S2O3十22NaOH
该反应中氧化剂是______(填化学式),生成?lmolCr(OH)3时转移电子的物质的量为______mol.
(2)步骤IV中电解Cr2O3的阳极反应式为______,此时Cr2O3?的状态为______.
(3)常温下,铬能慢慢溶于稀盐酸、稀硫酸,但不溶于浓硝酸.其不溶于浓硝酸的原因可能是______.
(4)已如:2CrO42-+2H+
Cr2O72-+H2O
①25.C,KSP(Ag2Cr2O4)=1.12×10-12,KSP(Ag2Cr2O7)=2×10-7,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是______.
②将wg固体Na2CrO4溶于适量水配成lL溶液,该溶液中有关粒子的浓度(mol?L-1)与pH的关系如下表:
由上表可知:
Ⅰ.要使溶液中CrO42-的量达到最大,应控制溶液的pH______(用>、<、=及相关数据表示).
Ⅱ. w g固体Na2CrO4的物质的量n=______(用数学表达式表示).
参考答案:(1)Cr化合价从+6→+3,化合价降低3,故Na2CrO4作氧化剂,生成?lmolCr(OH)3时转移电子的物质的量为 3mol.
故答案为:Na2CrO4 ?3.
(2)熔融状态时,Cr2O3?发生电离:Cr2O3═2Cr3++3O2-,电解Cr2O3的阳极反应式为:2O2--4e-═O2↑,
故答案为:2O2--4e-═O2↑ 液态(或熔融态).
(3)铬能慢慢溶于稀盐酸、稀硫酸,但不溶于浓硝酸,说明铬被浓硝酸氧化成致密的保护膜.
故答案为:表面生成致密氧化膜(或发生钝化).
(4)①因KSP(Ag2Cr2O4)=1.12×10-12,KSP(Ag2Cr2O7)=2×10-7,沉淀溶解平衡由溶解度小的向更小的方向转化,所以往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀为:Ag2CrO4.
故答案为:Ag2CrO4.?
?②观察表中数据可知,PH增大,c(CrO42-)增大,PH=9时,c(CrO42-)=0.996,故要使溶液中CrO42-的量达到最大,应控制溶液的pH>9;
铬元素存在形式有:CrO42-、Cr2O72-、HCrO4-,根据物料守恒w g固体Na2CrO4的物质的量为:n═n(CrO42-)+c(Cr2O72-)+n(HCrO4-).
故答案为:Ⅰ.>9Ⅱ.n(CrO42-)+c(Cr2O72-)+n(HCrO4-).
本题解析:
本题难度:一般