时间:2017-08-10 01:51:53
1、选择题 把0.1mol铝投入到。 100mL3mol/L的.NaOH溶液中充分反应后,再滴人lmol/L的H2SO4120mL,其结果(? )
100mL3mol/L的.NaOH溶液中充分反应后,再滴人lmol/L的H2SO4120mL,其结果(? )
A.溶液的pH<7
B.得到澄清透明溶液
C.有沉淀生成
D.先有白色沉淀生成,后逐渐溶解
参考答案:C
本题解析:略
本题难度:一般
2、选择题 十九世纪中期,铝的价格十分昂贵,甚至超过了当时黄金的价格.这是因为( )
A.铝的制备比较困难
B.铝是很稳定的金属
C.铝元素在自然界的含量很少
D.铝的用途太多
参考答案:A、十九世纪中期,金属铝的制取还没有合理的方法,制取困难加之量少,导致价格过高,故A正确;
B、金属铝的化学性质不稳定,易在表面形成一层氧化膜,故B错误;
C、金属铝在自然界中排第三位,含量不少,故C错误;
D、金属铝的用途广不是制约金属铝价格贵的原因,生产厂家多,则生产的量可以多,关键是制备比较困难,故D错误.
故选A.
本题解析:
本题难度:简单
3、选择题 (14分)金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下图所示:
其中,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1)当Al与稀硝酸反应时,稀硝酸表现的性质是
A.只表现强氧化性?
B.只表现酸性
C.同时表现强氧化性及酸性
D.表现了强氧化性还表现了还原性
(2)在下列离子方程式的横线上填写产物的化学式(不需要配平)
Al + NO3-+ OH-+ H2O—→ +
(3)过量D的水溶液与A溶液反应的离子方程式是 ?
(4)D—→C反应的化学方程式是?
(5)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质是
(6)除去C中的E气体杂质可用的化学方法是:(用化学方程式表示)?
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 ? 。
参考答案:(16分,每小题2分)
(1) C
(2) AlO2— + NH3
(3) 3NH3·H2O + Al3+ ="=" Al(OH)3↓+3 NH4+?
(4)? 4 NH3 +5O2 ="=" 4NO + 6 H2O
(5) N2
(6)? 3NO2 + H2O ="=" 2HNO3 + NO?
(7)? 1:1
本题解析:
金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,根据图示信息可知,在酸性环境下,反应生成铝盐和一氧化氮,碱性环境下生成偏铝酸盐和氨气,氨气催化氧化可以生成一氧化氮和水,一氧化氮可以和氧气反应生成二氧化氮,故A为硝酸铝,B为偏铝酸盐,C为NO,D为氨气,E为二氧化氮,F为硝酸.
(1)Al+4HNO3=Al(NO3)3+NO↑+2H2O,HNO3中的氮部分变价,同时表现强氧化性及酸性,选C;故答案为:C。
(2)由原子守恒和得失电子守恒得:碱性条件下铝以AlO2―形式存在,氨气催化氧化可以生成一氧化氮和水,故答案为: AlO2— + NH3
⑶过量的氨水不能溶解Al(OH)3, 3NH3·H2O + Al3+ ="=" Al(OH)3↓+3 NH4+发生反应生成氢氧化铝白色沉淀,故答案为: 3NH3·H2O + Al3+ ="=" Al(OH)3↓+3 NH4+
(4)D—→C反应的化学方程式:氨气催化氧化生成一氧化氮和水4 NH3 +5O2 ="=" 4NO + 6 H2O故答案为:4 NH3 +5O2 ="=" 4NO + 6 H2O
(5)6NO+4NH3=5N2+6H2O,8NH3+6NO2=5N2+12H2O,无毒氧化为N2, 故答案为: N2
⑹可以用水洗法,3NO2 + H2O ="=" 2HNO3 + NO,故答案为:3NO2 + H2O ="=" 2HNO3 + NO
⑺Al与NO3-在酸性条件下反应,金属铝被氧化为三价的铝离子,失去电子3mol,硝酸根被还原为一氧化氮,得到电子也是3mol,根据电子守恒,Al与被还原的NO3-的物质的量之比是1:1,故答案为:1:1.
本题难度:一般
4、选择题 下列物质中,既能与强酸反应,又能跟强碱反应的是( )①NaHCO3?②Al?③Al2O3?④Al(OH)3.
A.①②③
B.②③④
C.①③④
D.①②③④
参考答案:①、NaHCO3属于弱酸弱碱盐,既能与酸反应,生成CO2气体,又能与碱反应,生成盐,故①正确;
②、金属铝与酸反应生成Al3+和氢气,与碱反应生成AlO2-和氢气,故②正确;
③、Al2O3属于两性氧化物,既能与酸反应,生成Al3+离子,又能与碱反应生成AlO2-离子,故③正确;
④、Al(OH)3?属于两性氢氧化物,既能与酸反应,生成Al3+离子,又能与碱反应生成AlO2-离子,故④正确.
故选D.
本题解析:
本题难度:一般
5、填空题 (8分)查阅有关资料知:铝与氢氧化钠溶液反应实际是分以下两步进行:
第1步:2Al+6H2O=2Al(OH)3+3H2↑?第2步:Al(OH)3+NaOH=Na[Al(OH)4]
试回答下列问题:
(1)铝与氢氧化钠溶液反应的离子方程式为:?。
(2)判断两步反应的反应类型(用四种基本反应类型作答)
①第1步属?,②第2步属?。
(3)根据你的分析,铝与氢氧化钠溶液反应中氧化剂是?,
还原剂是___________。
(4)若将 Na[Al(OH)4] +4HCl = AlCl3 + NaCl + 4H2O 分两步进行,请写出第1步的化学方程式。
第1步:?
第2步:Al(OH)3 + 3HCl = AlCl3 + 3H2O
参考答案:(1)2Al + 2OH- +6H2O = 2[Al(OH)4]- +3H2↑?(2分)
(2)置换反应(1分)?化合反应(1分) ?(3)H2O(1分)? Al (1分)?
(4)Na[Al(OH)4] + HCl =" NaCl" +Al(OH)3↓+ H2O(2分)
本题解析:(1)①+②*2就会消去Al(OH)3,得到铝与氢氧化钠溶液反应的方程式;
(3)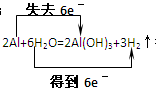 得到铝与氢氧化钠溶液反应中氧化剂是H2O,还原剂为Al;
得到铝与氢氧化钠溶液反应中氧化剂是H2O,还原剂为Al;
(4)总反应方程式减去第二步化学方程式,就会得到第一步化学方程式:Na[Al(OH)4] + HCl =" NaCl" +Al(OH)3↓+ H2O。
本题难度:一般