时间:2017-08-10 01:51:53
1、选择题 下列有关金属及其合金的说法不正确的是( )
A.目前我国流通的硬币是由合金材料制造的
B.生铁、普通钢的不锈钢中的碳含量依次增加
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
参考答案:A、目前我国流通的硬币是由合金材料制成:1角的为不锈钢,5角的为钢芯镀铜,1元的为钢芯镀镍,故A选项正确;
B、生铁含碳量最高,普通钢次之,不锈钢最少.题目说法与事实相反,故B选项说法错误.
C、制造照明弹就是利用了镁燃烧发出耀眼的白光,故C选项正确;
D、铝表面覆盖致密的氧化物薄膜,对金属起保护作用,故D选项正确.
故选B.
本题解析:
本题难度:一般
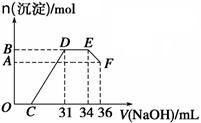
2、计算题 (15分)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | ? |
参考答案:Ⅰ.(1)合理(1分)
(2)NaOH溶液(2分) 2Al+2OH-+2H2O===2AlO+3H2↑(2分)
Ⅱ.(1) H++OH-===H2O(2分)
(2)NH+OH-===NH3·H2O或NH+OH-===NH3↑+H2O(2分)
(3)H+ > Fe3+ > Al3+ > NH(2分)
(4)0.008(2分)
(5)0.032(1分),7(1分)
本题解析:铝热反应2Al+Fe2O3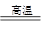 2Fe+Al2O3?2Al+2OH-+2H2O===2AlO+3H2↑
2Fe+Al2O3?2Al+2OH-+2H2O===2AlO+3H2↑
依图可知OC段酸碱中和,加入31ml的碱产生铝和铁的沉淀,34---36ml生成的氢氧化铝被强碱溶解。
Al(OH)3+OH-=AlO+2H2O
4 mol·L-1×4ml
本题难度:一般
3、填空题 (14分)镁、铝是两种重要的金属,它们的单质及化合物有着各自的性质。
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤: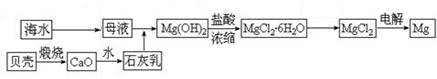
主要的步骤总结如下:①把贝壳制成石灰乳?②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀?③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
A.此法的优点之一是原料来源丰富
B.进行①②③步骤的目的是从海水中提取氯化镁
C.第④步电解法制取镁是由于镁是很活泼的金属
D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
(2)步骤②不够合理,理由是?
Ⅱ.(1)铝、空气、海水可组成一种电池,广泛用于制造航标灯。此电池正极的电极反应为?。
(2)铝热还原法是冶炼熔点较高的金属的一种重要方法,焊接钢轨即用到此法。将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先处理好),并架在铁架台上,
下面放置一个盛有沙子的蒸发皿。请写出引发铝热反应的操作及该反应的化学方程式:
操作?
化学方程式?。
(3)为确定某铝热剂(氧化铁粉末和铝粉)的组成,分别进行下列实验。
若取10.7g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况)体积为3.36L,反应的化学方程式为?,样品中铝的质量是?g。
若取10.7g样品将其点燃,恰好完全反应,待反应产物冷却后,加入足量盐酸,测得生成的气体体积为aL,该气体与上小题中所得气体的体积比等于?∶?。
参考答案:(14分)Ⅰ.(1)D (1分)
(2)石灰乳中的Ca(OH)2为微溶物,制得的Mg(OH)2不纯净。(1分)
Ⅱ.(1)(1)O2 + 4e-+2H2O?4OH-(2分)
(2)在混合物上面加入少量氯酸钾固体,中间插入一根用砂纸打磨过的镁条并点燃镁条。(2分)? 2Al+Fe2O3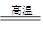 Al2O3+2Fe (2分)
Al2O3+2Fe (2分)
(3)2Al+2NaOH+2H2O==2NaAlO2+3H2↑ (2分)? 2.7 (2分)? 2:3 (2分
本题解析:Ⅰ.(1)把贝壳制成石灰乳涉及两步反应,首先贝壳高温分解制成氧化钙,然后氧化钙与水结合制成石灰乳;在引入的海水中加石灰乳后,石灰乳的主要成分氢氧化钙与海水中的镁离子结合生成氢氧化镁沉淀;氢氧化镁与盐酸反应生成氯化镁;电解熔融的氯化镁得到金属镁。分析上述转化过程,可知反应中没有涉及置换反应,D不正确,其余选项都是正确的,答案选D。
(2)由于石灰乳中的Ca(OH)2为微溶物,所以制得的Mg(OH)2不纯净,因此步骤②不够合理。
Ⅱ.(1)铝是活泼的金属,作负极,空气在正极通入,所以正极电极反应式是O2 + 4e-+2H2O?4OH-。
(2)铝热反应的正确操作是:在混合物上面加入少量氯酸钾固体,中间插入一根用砂纸打磨过的镁条并点燃镁条,反应的化学方程式是2Al+Fe2O3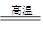 Al2O3+2Fe。
Al2O3+2Fe。
(3)铝热剂中和氢氧化钠溶液反应的是单质Al,所以反应的化学方程式是
2Al+2NaOH+2H2O=2NaAlO2+3H2↑。氢气的物质的量是3.36L÷22.4L/mol=0.15mol,因此根据方程式可知,Al的物质的量是0.1mol,质量是2.7g。发生铝热反应后生成单质铁的物质的量是0.1mol,因此铁再和酸反应生成的氢气是0.1mol,所以所得气体的体积比等于2︰3。
点评:在铝热反应的有关计算中,应该利用电子的得失守恒进行有关计算,但在该题中,由于铁和稀硫酸反应失去2个电子,而不是3个电子,所以如果直接利用电子得失守恒则很容易得出1︰1的错误结论。因此在具体的计算中,还需要具体问题具体分析,灵活运用。
本题难度:一般
4、选择题 下列有关金属及其化合物的说法错误的是
A.铁与水蒸气在高温条件下反应生成四氧化三铁和氢气
B.稀硫酸中加入铜粉不反应,再加入硝酸钠仍不反应
C.AlCl3、FeCl2、CuCl2均可通过化合反应制得
D.饱和碳酸钠溶液中通人足量二氧化碳,溶液变浑浊
参考答案:B
本题解析:A、铁与水蒸气在高温条件下反 应生成四氧化三铁和氢气,正确;B、稀硫酸中加入铜粉不反应,再加入硝酸钠发生的反应为:3Cu + 2NO3- + 8H+ ="===" 3Cu2+ + 2NO↑+ 4H2O,错误;C、AlCl3、CuCl2均可通过单质与氯气化合制得,FeCl2可通过铁与氯化铁溶液化合制得,正确;D、饱和碳酸钠溶液中通入足量二氧化碳,生成碳酸氢钠,碳酸氢钠的溶解度小于碳酸钠,溶液变浑浊,正确。
本题难度:一般
5、实验题 某研究性学习小组用不纯的氧化铝(杂质为Fe2O3)为原料,设计了冶炼铝的以下工艺流程(部分反应产物没有标出):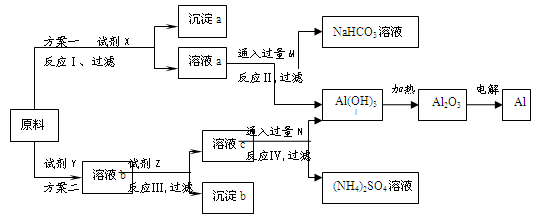
(1)试剂X的化学式为?,反应Ⅰ的离子方程式是?。实验室配制480mL 1 mol·L-1 X的溶液必须用到玻璃仪器除烧杯、玻璃棒、试剂瓶、胶头滴管外,还有?。常用来可以标定所配X的溶液浓度是否准确的实验名称是?。
(2)按照方案设计,试剂Z的作用是调节溶液的pH,以生成沉淀b[Fe(OH)3]。从试剂工业的角度,你认为方案?更合理,理由是?。
(3)已知N为氨气,实验室中还可以用下图装置制取氨气并进行氨气喷泉实验。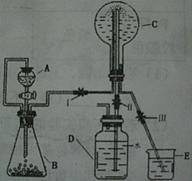
①仪器A的名称是?,装置中A口部和B口部之间联通导气管的作用是?。
②若用此装置制备N气,若A中盛有浓氨水,则B装置中的固体试剂不可以选用下列的?(填字母序号)。
a.生石灰? b.烧碱? c.胆矾? d.碱石灰
(4)室温下,在a mol·L-1的(NH4)2SO4水溶液中pH=5,存在着平衡NH4++H2O  NH3·H2O+H+,则该平衡常数的表达式为?(用含代数a的较为精确地数字表达式表示,不必化简,不做近似运算)。
NH3·H2O+H+,则该平衡常数的表达式为?(用含代数a的较为精确地数字表达式表示,不必化简,不做近似运算)。
参考答案:
(1)NaOH(1分),Al2O3+2OH-+3H2O=2[Al(OH)4]-(2分),500mL容量瓶(2分,不写500mL只得1分),滴定或中和滴定(1分);
(2)方案一(1分),步骤少,较简单(2分);
(3)①长颈漏斗(1分),平衡内外压强,防止长颈漏斗堵塞(2分);
(4)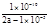 (2分)。
(2分)。
本题解析:
(1)流程图中的原料为:氧化铝(杂质为Fe2O3),方案I中为先加入强碱溶液过滤后再向溶液中通入二氧化碳气体,即得到氢氧化铝再进行后续步骤;故此试剂X一般选用NaOH;反应I为:Al2O3+2OH-+3H2O=2[Al(OH)4]-;配制480mL 1 mol·L-1氢氧化钠溶液时,应选取500mL容量瓶且必须标明容量瓶的容积;确定配制溶液的浓度是否准确,应进行滴定或中和滴定实验;
(2)方案二中,首先加入硫酸溶解氧化铁和氧化铝,再在步骤二中加入试剂调整pH值析出氢氧化铁沉淀,过滤后再向硫酸铝溶液中通入氨气,制取氢氧化铝;分析两方案,很明显方案一步骤少,较简单,是较佳方案;
(3)根据装置图,制取氨气并完成喷泉实验时,仪器A为长颈漏斗;A口部和B口部之间联通导气管的作用是平衡内外压强,防止长颈漏斗堵塞;
(4)a mol·L-1的(NH4)2SO4水溶液中pH=5,则溶液中的c(H+)=10-9mol·L-1,故c(NH3·H2O)=c(OH-)=10-5mol·L-1,c(NH4+)=2a-10-5mol·L-1,根据水解的离子方程式:NH4++H2O  NH3·H2O+H+,可得k=
NH3·H2O+H+,可得k=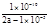 。
。
本题难度:一般