时间:2017-08-10 01:46:29
1、选择题 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如右图所示变化:已知一个B分子中含有的Z元素的原子个数比C分子中的少一个,B、C两种分子中的电子数均等于10,.下列说法错误的是( )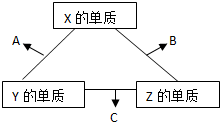
A.X元素在周期表中的位置是:第二周期ⅥA族
B.X元素与Z元素可以形成Z2X和Z2X2的离子化合物
C.Y元素的氢化物能与它的最高价的氧化物的水化物反应生成盐
D.Y的单质与X的单质生成A的反应有一定的可逆性,生成的A可写成YX
参考答案:短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),且一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10,则X、Y、Z分别为O、N、H,A、B、C分别为NO、H2O、NH3,则
A.X为O元素,原子序数为8,位于周期表第二周期ⅥA族,故A正确;
B.X和Z形成的化合物有H2O和H2O2,都属于共价化合物,故B错误;
C.Y元素的氢化物能为NH3,它的最高价的氧化物的水化物为HNO3,二者反应生成NH4NO3,故C正确;
D.N2和O2的反应为可逆反应,生成物为NO,故D正确.
故选B.
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
[? ]
A.含有离子键的化合物必是离子化合物
B.含有共价键的物质就是共价化合物
C.共价化合物可能含有离子键
D.离子化合物中可能含有共价键
参考答案:AD
本题解析:
本题难度:简单
3、填空题 已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
⑴Y、Z、W元素的第一电离能由大到小的顺序是 ? 。
⑵K的二价离子电子排布式是 ? 。
⑶Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ? ;Y、Z的这些氢化物的沸点相差较大的主要原因是 ? 。
⑷若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ? ;1 mol该分子中含有 σ键的数目是 ? 。
⑸Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ? ,Z原子的配位数是 ? 。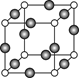
参考答案:⑴N>O>C?⑵[Ar] 3d9?⑶C2H6氮的氢化物(N2H4)分子间存在氢键?
⑷sp2? 4NA?⑸Cu3N ?6
本题解析:根据题意可知这几种元素分别是:X是H;Y是C;Z是N;W是O;K是Cu。⑴一般情况下,同一周期的元素,元素的非金属性越强,其失去电子越难,即第一电离能就越大。但是由于N原子的电子处于半充满的稳定状态,所以失去电子比O还难,因此C、N、O元素的第一电离能由大到小的顺序是N>O>C。⑵29号元素Cu的二价离子电子排布式是[Ar] 3d9。(3)具有18个电子的碳元素的氢化物的化学物质为C2H6。具有18个电子的氮元素的氢化物的化学物质为N2H4。C2H6、N2H4的沸点相差较大是因为在乙烷C2H6的分子间只有分子间作用力,而在联氨N2H4的分子间除了有分子间作用力外,还存在氢键。增加了分子之间的相互作用。⑷若H、O、C形成的某化合物呈酸性,相对分子质量为46的物质为甲酸HCOOH。该化合物分子中Y原子轨道的杂化类型sp2杂化。在1 mol该分子中含有 σ键的数目是4NA。⑸在该晶胞中含有的N原子个数为:8×1/8="1;" 含有的Cu原子个数为:12×1/4=3.所以该晶体的化学式为Cu3N。在晶体中与N原子距离相等且最近的Cu原子个数为6,它们分别在N原子的上、下、前、后、左、右六个方向。因此N原子的配位数是6。
本题难度:一般
4、选择题 只有在化合物中才能存在的化学键是
[? ]
A.离子键
B.共价键
C.非极性键
D.极性键
参考答案:AD
本题解析:
本题难度:简单
5、选择题 能够用键能的大小作为主要依据来解释的是
[? ]
A.常温常压下氯气呈气态而溴单质呈液态
B.硝酸是挥发性酸,而硫酸、磷酸是不挥发性酸
C.稀有气体一般难于发生化学反应
D.空气中氮气的化学性质比氧气稳定
参考答案:D
本题解析:
本题难度:简单