时间:2017-08-10 01:43:16
1、实验题 (6分)某化学兴趣小组用铁矿石(主要成分为Fe203,还有Si02、A1203
等杂质)提取Fe2O3。操作讨程如下: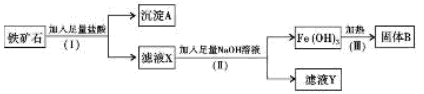
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是?;
(2)沉淀A中主要含有?,固体B是?;
(3)滤液Y中的阴离子除OH-、Cl-外,还有?;
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式?
2、填空题 硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和二氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图: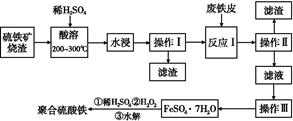
(1)实验室实现“操作Ⅰ”所用的玻璃仪器有 、玻璃棒和烧杯。“操作Ⅲ”系列操作名称依次为 、 、过滤和洗涤。?
(2)“酸溶”过程中Fe3O4溶解的化学反应方程式为?。
(3)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是?。
(4)实验室检验“反应Ⅰ”已经完全的试剂是 ,现象是?。
(5)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式:?。
3、实验题 草酸亚铁(FeC2O4)常用作分析试剂、显影剂以及新型电池材料磷酸亚铁锂的生产。草酸亚铁在隔绝空气时加热能够分解,兴趣小组对草酸亚铁的分解产物进行了实验和探究。(已知:CO能与氯化钯[PdC12]溶液反应生成黑色的钯粉。)
(1)将草酸亚铁分解的气体产物依次通过澄清石灰水和氯化钯溶液,观察到澄清石灰水变浑浊,氯化钯溶液中有黑色物质生成。说明气体产物中有?。(填化学式)
(2)探究草酸亚铁分解得到的黑色固体产物中铁元素的存在形式。
【发现问题】
草酸亚铁分解后得到的黑色物质是什么?
【提出假设】
猜想1:?;猜想2:FeO;猜想3:FeO和Fe的混合物。
【实验方案】
限选试剂:盐酸、氯水、CuSO4溶液、KSCN溶液、蒸馏水。
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量?,充分振荡。 | 若溶液颜色明显改变, 且有红色固体生成。 | 有Fe存在。 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水将固体洗涤至洗涤液呈无色。 | ? | ? |
| 步骤3:取步骤2得到的少量固体于试管中,滴加过量盐酸,静置后取上层清液,? ?。 | ? ?。 | 有FeO存在。 |
4、选择题 用黄色的FeCl3溶液分别进行下列实验,解释或结论不正确的是? ( )。
| 选项 | 实验 | 现象 | 解释或结论 |
| A | 加入FeCl3固体 | 溶液变成红褐色 | FeCl3的水解程度变大 |
| B | 加入等体积水 | 溶液颜色变浅 | c(Fe3+)变小 |
| C | 加入足量Fe粉 | 溶液颜色变成浅绿色 | 2Fe3++Fe=3Fe2+ |
| D | 将FeCl3溶液微热 | 溶液变成红褐色 | 水解反应ΔH>0 |
5、填空题 磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上采用生产钛白粉的下脚料(含大量FeSO4溶液)制备磁材氧化铁的步骤如下: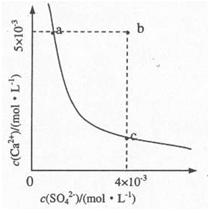
①向下脚料(含大量FeSO4溶液)中加入少量2 mo1·L-1叫H2SO4和铁皮;
②向①中所得溶液中加絮凝剂和水,经过滤除去吸附了杂质的絮凝剂;
③将②所得的滤液浓缩结晶得到晶体A;
④将晶体A溶于水,并加入NH4HCO3,产生CO2气体同时得到FeCO3沉淀和无色溶液C;
⑤将FeCO3沉淀洗涤、烘干并煅烧。(煅烧中的变化为:FeCO3="FeO+CO2↑;?" 4FeO+O2="2" Fe2O3)
据上述信息回答下列问题:
(1)用18.4mo1·L-1的H2SO4配制500mL 2 mo1·L-1H2SO4,所需玻璃仪器除
??mL量筒、玻璃棒、烧杯、500mI。容量瓶外,还需要?。
(2)步骤①中2 mo1·L-1H2SO4和铁皮的作用分别为?。
(3)晶体A的化学式为?,检验溶液C中溶质阳离子的方法是?。
(4)向溶液C中加入CaCl2溶液能得到CaSO4沉淀,常温下KSP(CaSO4)=9x10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。
①a点对应的KSP?c点对应的KSP填“大于”、“小于”或“等于”);
②若由b点变到a点下列措施可行的是??。
A.加入适量CaCl2
B.加入适量BaCl2.
C.加人适量Na2SO4
D.蒸发