时间:2017-08-10 01:43:16
1、选择题 下列物质不能与氢氧化钠溶液反应的是( )
A.Fe2O3
B.Al(OH)3
C.NaHCO3
D.H2SiO3
参考答案:A
本题解析:
本题难度:简单
2、选择题 将锌、铁、铜粉末按一定比例混合投入到一定量的硝酸中,微热,充分反应后过滤,弃去滤渣,滤液中金属阳离子情况不可能是
A.只含Cu2+、Fe2+、Zn2+
B.只含Zn2+
C.只含Fe2+、Zn2+
D.只含Cu2+、Fe3+、Zn2+
参考答案:D
本题解析:微热,充分反应后过滤,弃去滤渣,说明金属有剩余,溶液中一定不能含有Fe3+,故D不可能。
本题难度:一般
3、选择题 有一种铁的氧化物样品,用140 mL 5 mol·L-1盐酸恰好使之完全溶解,所得溶液能吸收0.56 L(标准状况)氯气,使其中的Fe2+全部转化为Fe3+,该样品可能的化学式是(?)
A.Fe2O3
B.Fe3O4
C.Fe4O5
D.Fe5O7
参考答案:D
本题解析:铁的氧化物用盐酸溶解后,生成FeCl3、FeCl2,由0.56 L Cl2可知有Fe2+ 0.05 mol。
Cl-共0.7 mol,FeCl3的Cl-为0.6 mol,Fe3+为0.2 mol。
Fe3+∶Fe2+为4∶10→2Fe2O3·FeO→Fe5O7,选D。
本题难度:简单
4、选择题 一定量的Fe和Fe2O3混合物投入250ml 2mol/L的HNO3溶液中,反应完全后,无固体剩余,生成1.12L NO气体(标况),再向反应后溶液中加入1 mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是
A.450ml
B.500ml
C.400ml
D.无法确定
参考答案:A
本题解析:略
本题难度:一般
5、实验题 (14分)FeSO4·7H2O广泛用于医药和工业领域,以下是FeSO4·7H2O的实验室制备流程图。根据题意完成下列填空:
(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_____,浸泡后,用____(填操作方法)分离并洗涤铁屑。
(2)操作a为_______________。
(3)最后得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;
②____________________。
(4) FeSO4·7H2O是某些补血剂的主要成分,实验室要测定某补血剂中铁元素的含量。
I.方案一:可用KMn04溶液进行氧化还原滴定。在配制100mL 1.00 × 10 - 2 mol·L-1的KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还有___________(填仪器名称)。在配制过程中,下列说法正确的是____________(填序号字母)。
A.KMnO4溶于水不放热,可以直接在容量瓶中溶解
B.容量瓶洗涤后不需干燥即可直接用于实验
C.定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平
D.如果定容时加水超过刻度线必须毓配制
II.方案二:将FeSO4·7H2O最终转化为Fe2O3,测定质量变化,操作流程如下: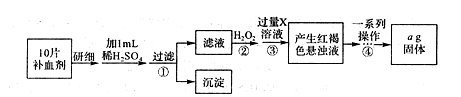
①步骤④中一系列操作依次是:过滤、洗涤、______、冷却、称量。
②假设实验过程中Fe无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示)。
③若步骤③加入X溶液的量不足,则最后测出每片补血剂含铁元素的质量将______(填“偏大,’.“偏小”或“不变”)。
参考答案:(1)除去废铁屑表面的油污(1分),倾倒法(1分) (2)趁热过滤(2分)
(3)减少洗涤过程中FeSO4·7H2O的损耗(2分)
(4)I.100ml容量瓶、胶头滴管(2分) BD(2分)
Ⅱ.①灼烧(1分) ②0.07a(2分) ③偏小(1分)
本题解析:(1)CO32-水解生成OH-,溶液显碱性,酯在碱性条件下完全水解,所以可用纯碱溶液除油污。铁是不溶于水的金属,要分离铁可以直接倾倒法。
(2)根据硫酸亚铁溶液的后续操作是冷却结晶可知,操作a应该是趁热过滤得到硫酸亚铁溶液。
(3)由于硫酸亚铁的溶解度随温度的升高二增大,因此用冰水洗涤的另一个目的是减少洗涤过程中FeSO4·7H2O的损耗。
I.(4)100mL 1.00×10 - 2 mol·L-1的KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还需要有100ml容量瓶、胶头滴管;A、配制任何溶液都不能在容量瓶中溶解溶质,A不正确;B、由于容量瓶中含有蒸馏水对实验结果不会造成影响,所以容量瓶洗涤后不需干燥即可直接用于实验,B正确;C、定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平,则容量瓶中溶液的体积增加,浓度偏低,C不正确;D、如果定容时加水超过刻度线必须重新配制,D正确,答案选BD。
Ⅱ.①步骤④最终得到氧化铁固体,所以其过程为过滤、洗涤、灼烧、冷却、称量、恒重.故答案为:灼烧;
②agFe2O3中Fe元素质量为:ag×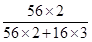 =0.7ag,由铁元素守恒,1片补血剂中铁元素质量为0.07ag,故答案为:0.07a。
=0.7ag,由铁元素守恒,1片补血剂中铁元素质量为0.07ag,故答案为:0.07a。
③若步骤③加入X溶液的量不足,则导致溶液中铁离子不能完全转化为氢氧化铁,因此最后测出每片补血剂含铁元素的质量将偏小。
本题难度:困难