时间:2017-08-10 01:40:45
1、实验题 2001年6月21日,河南的郑州、洛阳及南阳市率先使部分汽车采用封闭运行方式,试用新的汽车燃料——车用乙醇汽油。乙醇,俗名酒精,它是以玉米、小麦、薯类等为原料经发酵、蒸馏而制成的。乙醇进一步脱水,再加上适量汽油后形成变性燃料乙醇。而车用乙醇汽油就是把变性燃料乙醇和汽油按一定比例混配形成的车用燃料。结合有关知识,完成以下问题:
(1)乙醇的结构简式为_____________。汽油是由石油分馏所得的低沸点烷烃,其分子中的碳原子数一般在C5—C11范围内,如戊烷,其分子式为__________________,结构简式及其同分异构体分别为_____________、_____________、_____________。
(2)乙醇可由含淀粉〔(C6H10O5)n〕的农产品,如玉米、小麦、薯类等经发酵、蒸馏而得。请写出由淀粉制乙醇的化学方程式:
①淀粉+水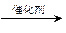 葡萄糖(C6H12O6)
葡萄糖(C6H12O6)
②葡萄糖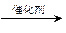 乙醇
乙醇
(3)淀粉可由绿色植物经光合作用等一系列生物化学反应得到,即水和二氧化碳经光合作用生成葡萄糖,由葡萄糖再生成淀粉。进行光合作用的场所是_____________,发生光合作用生成葡萄糖的化学方程式是
__________________________________________________________。
(4)乙醇充分燃烧的产物为__________________和__________________。
(5)车用乙醇汽油称为环保燃料,其原因是__________________________________________。
参考答案:(1)C2H5OH? C5H12? CH3—CH2—CH2—CH2—CH3?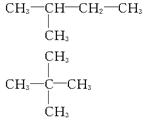
(2)①(C6H10O5)n+nH2O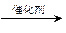 nC6H12O6
nC6H12O6
②C6H12O6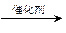 2C2H5OH+2CO2
2C2H5OH+2CO2
(3)叶绿体? 6CO2+6H2O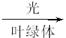 C6H12O6+6O2
C6H12O6+6O2
(4)CO2? H2O
(5)能有效降低汽车尾气带来的严重大气污染,改善环境质量
本题解析:本题是化学与生物相结合的题目,乙醇、汽油燃烧,生成CO2和水,不会对环境造成污染。
本题难度:简单
2、选择题 某碳酸钾样品中的杂质含有纯碱、硝酸钾、硝酸钡中的一种或两种。取7.8 g该样品溶于适量水中得到澄清溶液,再加入过量CaCl2溶液得到沉淀5.0 g。下列对原样品中所含杂质的判断正确的是(?)
A.一定没有Na2CO3和Ba(NO3)2
B.一定有Na2CO3而没有Ba(NO3)2
C.没有Ba(NO3)2但有KNO3,可能还有Na2CO3
D.没有Na2CO3但有Ba(NO3)2和KNO3
参考答案:C
本题解析:由于样品溶于水是澄清的,因此样品中不存在硝酸钡,设样品没有杂质,则生成沉淀为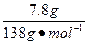 ×100 g·mol-1≈5.65 g>5.0 g,因此,样品中一定含有硝酸钾,可能含有碳酸钠,C正确。
×100 g·mol-1≈5.65 g>5.0 g,因此,样品中一定含有硝酸钾,可能含有碳酸钠,C正确。
本题难度:简单
3、填空题 某工厂的废水中含有FeSO4、H2SO4、Ag2SO4、Al2(SO4)3及一些污泥。某研究性学习课题组测定了废水中各物质的含量并查找了溶解度数据,现列表如下
表一废水中各物质的含量
| 物质 | FeSO4 | H2SO4 | Ag2SO4 | Al2(SO4)2 | 污泥 |
| 质量分数/(%) | 15.0 | 7.0 | 0.40 | 0.34 | 5.0 |
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| FeSO4溶液度(g) | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 |
| Al2(SO4)3溶解度(g) | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 |
参考答案:(1)① 洗去油污 (1分) ③ 在②的滤液中加入稍过量的洗涤过的废铁屑(1分),
充分反应后过滤(1分)
④ 将③的滤渣溶入足量的稀硫酸(1分),过滤,滤液保留待用(1分)
(2)⑤③ (2分)将溶液加热(温度不超过80℃)蒸发浓缩(1分),冷却结晶(1分)
(3)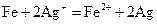 ,
, 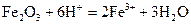 ,
, ,
, 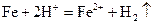 (4分)
(4分)
(4)抑制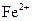 的水解(防止
的水解(防止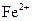 被氧化)(2分)
被氧化)(2分)
本题解析:略
本题难度:一般
4、实验题 (16分)某课外小组在实验室制备氨气,并进行有关氨气的性质探究。
(1)该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气。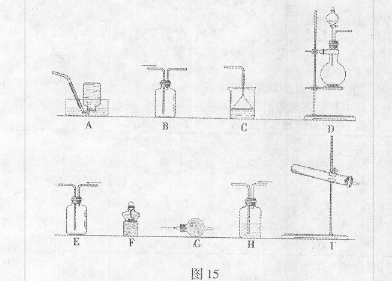
①应该选用的仪器及装置有(填字母)?。
②生石灰与氯化铵反应生成氨气的化学方程式为?。
(2)该小组同学设计如图16所示装置探究氨气的还原性。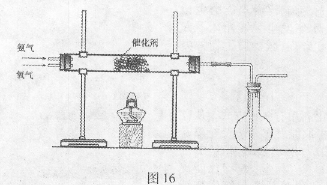
①氨催化氧化的化学方程式为?。
②若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为?。
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵。
①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。再选择合适的方案并说明原因。
②检验产物中有NH4+的方法为?。
参考答案:
(1)①I、F、G、E、C? …………………………………………………………3分
(不要求顺序;写错、多写、少写1个扣1分)
② CaO + 2NH4Cl CaCl2 + 2NH3↑+ H2O?…………………………2分
CaCl2 + 2NH3↑+ H2O?…………………………2分
(2)① 4NH3 + 5O2 4NO + 6H2O?…………………………………2分
4NO + 6H2O?…………………………………2分
②NH4NO3?………………………………………………………3分
(3)①乙同学方案合理。(不写不扣分)
二氧化碳在水中溶解度较小,先通入二氧化碳,再通入氨气,生成的产物量少,且易生成碳酸铵;? ………………………………………………………1分
氨气在水中溶解度很大,先通入氨气,再通入二氧化碳,生成的产物量多,且易生成碳酸氢铵;? ………………………………………………………1分
应选择乙同学方案。? ………………………………………………………1分
②取少量产物放入试管中,加入浓NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸,若试纸变蓝,则证明产物中有NH4+。? ……………………………3分
(完整答案应包括取样、加试剂、操作、现象、结论,少1部分扣1分,扣完为止)
本题解析:略
本题难度:一般
5、实验题 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中观察到一些现象,并产生了相关的思考。
(1)向盛KI溶液的试管中滴加氯水,溶液呈棕黄色。如果继续向试管中滴加氯水,充分振荡,溶液逐渐变浅,最后变成无色。写出并配平溶液由棕黄色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)将KI溶液换成KBr溶液,滴加氯水,溶液呈橙黄色;滴加氯水至过量,颜色没有变化。则Cl2、HIO3、HBrO3氧化性由强到弱的顺序是?。
(3)为证明溴单质的氧化性强于Fe3+,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈棕黄色。为了证明棕黄色溶液是由于Fe3+的存在,而不是溴单质颜色所致,应当采取的补充实验是?
(4)在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br—被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为?
参考答案:(1)I2 + 5Cl2 + 6H2O→2HIO3 + 10HCl
(2)HBrO3>Cl2>HIO3?
(3)取少量溶液,在其中滴加KSCN溶液,若溶液变血红色,则说明是Fe3+。(也可以利用苯互四氯化碳做萃取实验)
(4)1.2mol/L
本题解析:氧化性:氧化剂大于氧化产物
(1)KI被氯气氧化为碘单质,得到棕黄色的碘水:Cl2+2I-=2Cl-+I2;
继续滴加氯水,碘被氧化为KIO3,而氯气只能被还原为氯呈—1价的HCl:I2 + 5Cl2 + 6H2O=2HIO3 + 10HCl
从上式可得出氧化性:Cl2>HIO3
(2)KBr被氯气氧化为溴单质,得到橙黄色的溴水:Cl2+2Br-=2Cl-+Br2;但氯气并不能将溴单质继续氧化为HBrO3,从反面说明氧化性HBrO3>Cl2,综合可知氧化性:HBrO3>Cl2>HIO3
(3)溴可将浅绿色的Fe2+氧化为棕黄色的Fe3+:2Fe2++Br2=2Br-+2Fe3+,但溴单质在水中呈现的颜色也非常接近于棕黄色,由于提供了足量的稀氯化亚铁溶液,如果上式发生,则溶液中生成Fe3+,可通过KSCN溶液来检验;或者用有机溶液来萃取溴,观察有机层的颜色也可判定溶液中是否还存在溴单质
(4)由上面可知,还原性Fe2+>Br-,故氯气首先氧化Fe2+再氧化Br-
设FeBr2的物质的量为amol,由电子的得失守恒可知:a+2a/3=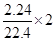 ,求得a=0.12mol
,求得a=0.12mol
故原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L
本题难度:简单