时间:2017-08-10 01:17:31
1、填空题 (8分)(每空2分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈 性,原因 (用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为 。
(4)已知Ka(CH3COOH)= 1.76×10-5,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:前者 后者(填“>,<或=”)
2、选择题 已知弱酸的电离平衡常数如下表: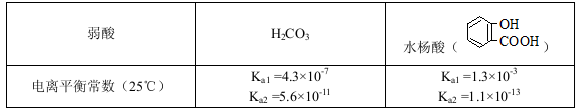
下列选项正确的是
A.常温下,等浓度、等体积的NaHCO3溶液pH小于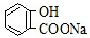 溶液pH
溶液pH
B.常温下,等浓度、等体积的Na2 CO3溶液和 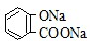 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者
C.
D.水杨酸的第二级电离 Ka2远小于第一级电离Ka1的原因之一是 能形成分子内氢键
3、选择题 常温时,将CH3COOH溶液和NaOH溶液等体积混合后,溶液呈中性。则下列各项正确的是? ( )。
A.混合前:pH(CH3COOH)+pH(NaOH)=14
B.混合后:c(Na+)=c(CH3COO-)+c(OH-)
C.混合前:c(CH3COOH)>c(NaOH)
D.混合后:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
4、选择题 常温时,pH=2.7的一元弱酸溶液加水稀释,若溶液体积扩大10倍,则溶液中的变化是
[? ]
A. [H+]增大
B. [H+]、[OH-]都减小
C. [OH-]增大
D. [H+]×[OH-]不变
5、选择题 下列图示与对应的叙述相符的是

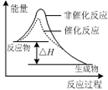

图甲 图乙 图丙 图丁
A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B.图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C.图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D.图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系