时间:2017-08-10 01:03:44
1、填空题 (6分)用铜、银与硝酸银设计一个原电池,此电池的负极是:?,
负极的电极反应式是:?,
总反应方程式为?。
参考答案:负极是 Cu ,负极的电极反应式 Cu - 2e- ="=" Cu2+;总反应式 Cu + 2Ag+ ="=?" 2Ag + Cu2+。
本题解析:略
本题难度:简单
2、填空题 (1)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2该电池反应的化学方程式是________。
(2)化学在环境保护中起着十分重要的作用,催化反硝化学法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO的原理如图所示。
①电源正极为__________(填A或B),阴极反应式为________________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为__________克。
(3)能量之间可相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图(见图),并作相应标注,要求:在同一烧杯中,电极与溶液含相同的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极__________。
③甲乙两种原电池可更有效地将化学能转化为电能的是________,其原因是_________________________________________________________________。
④根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在所给的材料中应选__________作阳极。
参考答案:(1)Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2
(2)①A 2NO3-+6H2O+10e-=N2↑+12OH-
②14.4
(3)① (或其他合理答案)
(或其他合理答案)
②失去金属光泽,被腐蚀或氧化,溶液蓝色变浅
③甲 在甲装置中,两个电极反应是在彼此隔离的条件下进行的,锌与Cu2+不直接发生反应,这样可以更彻底地将反应所释放的能量转化为电能 ④锌片
本题解析:(1)该新型电池放电时,关键判断Al的氧化产物。由于NaOH溶液的存在,Al被氧化生成NaAlO2而不是Al(OH)3,故电池反应的化学方程式为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2。
(2)阴极:2NO3-+6H2O+10e-=N2↑+12OH-
阳极:10OH--10e-=5H2O+ ?O2↑
?O2↑
在阳极区生成的H+通过质子交换膜到达阴极区,所以,当电子过程中转移
10 mol e-时,
Δm左= ?mol×32 g·mol-1+10 g=90 g
?mol×32 g·mol-1+10 g=90 g
Δm右=28 g-10 g=18 g
所以当转移2 mol e-时,膜两侧电解液的质量变化差为 =14.4 g。
=14.4 g。
(3)①根据题给条件和原电池的构成条件可得:
a.若用Zn、Cu、CuSO4(aq)、ZnSO4(aq)组成原电池,Zn作负极,Cu作正极,Zn插入到ZnSO4(aq)中,Cu插入到CuSO4(aq)中。
b.若用Fe、Cu、FeSO4(aq)、CuSO4(aq)组成原电池,Fe作负极,Cu作正极,Fe插入到FeSO4(aq)中,Cu插入到CuSO4(aq)中。
c.注意,画图时要注意电极名称,电极材料,电解质溶液名称(或化学式),并形成闭合回路。②由于金属活动性Zn>Fe>Cu,锌片或铁片作负极,由于Zn或Fe直接与CuSO4溶液接触,工作一段时间后,负极本身被腐蚀或氧化,失去金属光泽,质量减轻,蓝色变浅。③带有盐桥的甲原电池中负极没有和CuSO4溶液直接接触,二者不会直接发生置换反应,化学能不会转化为热能,几乎全部转化为电能;而原电池乙中的负极与CuSO4溶液直接接触,两者会发生置换反应,部分化学能转化为热能,化学能不可能全部转化为电能。④由牺牲阳极的阴极保护法可得,铁片作正极(阴极)时被保护,作负极(阳极)时被腐蚀,所以应选择比铁片更活泼的锌作负极(阳极)才能有效地保护铁不被腐蚀。
本题难度:一般
3、简答题 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的印刷电路板铜箔.某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列流程:
(1)写出流程①中回收金属铜时发生反应的离子方程式______.请根据上述反应设计一个原电池,在方框中画出简易装置图(标出相应电极名称、电极材料、电解质溶液)______.
(2)写出图流程③相关反应的化学方程式:______.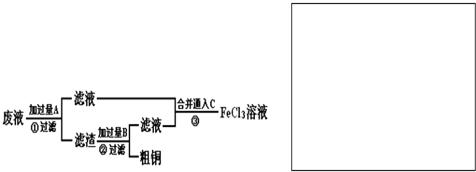
参考答案:(1)流程①中回收金属铜时,涉及反应为铁与氯化铜的反应,离子方程式为Fe+Cu2+=Fe2++Cu,如将该反应涉及成原电池,则铁为负极,正极可用碳棒,电解质溶液为硫酸铜,装置为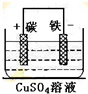 ,
,
故答案为:Fe+Cu2+=Fe2++Cu; ;
;
(2)流程③为氯气和氯化亚铁的反应,方程式为2FeCl2+Cl2=2FeCl3,故答案为:2FeCl2+Cl2=2FeCl3.
本题解析:
本题难度:一般
4、选择题 关于原电池的下列说法中,不正确的是( )
A.在负极上发生氧化反应
B.化学性质较活泼的金属为负极
C.在外电路上电子由负极流向正极
D.是由电能转化为化学能的装置
参考答案:A、原电池放中,负极上失去电子发生氧化反应,故A正确;
B、原电池放中,化学性质较活泼的金属为负极,负极上失去电子发生氧化反应,故正确;
C、原电池放电时,负极上失去电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流下正极,故C正确.
D、原电池是把化学能转变为电能的装置,故D错误;
故选D.
本题解析:
本题难度:简单
5、选择题 如图所示,将铁棒和石墨棒插入l L l mol·L-1食盐水中。下列说法正确的是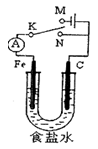
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH-—4e-=2H2O+O2↑
C.若电键K与M连接,若在溶液中滴入酚酞试液,则在石墨棒附近先出现红色
D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
参考答案:D
本题解析:A 错误,若电键K与N连接,铁、碳形成原电池,铁做负极,容易腐蚀
B 错误,正极反应为吸氧腐蚀,O2+4e-+2H2O=4OH-
C 错误,若电键K与M连接,铁做阴极,若在溶液中滴入酚酞试液,则在铁棒附近先出现红色
D 正确。
本题难度:一般