时间:2017-08-10 00:21:34
1、填空题 设反应①Fe(S)+CO2(g) FeO(S)+CO(g)的平衡常数为
FeO(S)+CO(g)的平衡常数为 。反应②Fe(S)+H2O(g)
。反应②Fe(S)+H2O(g) FeO(S)+H2(g)的平衡常数为
FeO(S)+H2(g)的平衡常数为 ,在不同温度下,
,在不同温度下, 、
、 的值如下:
的值如下:
| 温度 |  |  |
 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
 H2O(g)+CO(g)写出该反应的平衡常数K3的数学表达式:K
H2O(g)+CO(g)写出该反应的平衡常数K3的数学表达式:K =____________。
=____________。 、K
、K 与K
与K 之间的关系式_______________。据此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有_____________(填写序号)。
之间的关系式_______________。据此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有_____________(填写序号)。 达到平衡、在时刻t
达到平衡、在时刻t 分别因改变某个条件而发生变化的情况:
分别因改变某个条件而发生变化的情况:
 发生改变的条件是_____________________________
发生改变的条件是_____________________________ 发生改变的条件是________________
发生改变的条件是________________参考答案:(1)吸?(2)
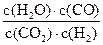 ?(3)
?(3)
(4)①加入催化剂或增大体系的压强?②降低温度或增加水蒸汽的量或减少氢气的量
本题解析:略
本题难度:简单
2、选择题 一定温度下,氢氧化镁饱和溶液中存在如下关系:c(Mg2+)?[c(OH-)]2=Ksp,其中Ksp为常数,称为该温度下Mg(OH)2的溶度积常数.试推断氢氧化镁在下列物质中的溶解度由大到小的顺序是( )
①0.1mol?L-1AlCl3溶液?②0.1mol?L-1NH4Cl溶液
③0.1mol?L-1KCl溶液?④0.1mol?L-1?KAlO2溶液.
A.①④③②
B.①②③④
C.③①④②
D.④①③②
参考答案:根据氢氧化镁的溶解平衡:Mg(OH)2(s)
Mg2+(aq)+2OH-(aq),若促进氢氧化镁溶解,应使平衡向右移动,则有酸性越强,溶解度越大,
AlCl3、NH4Cl水解使溶液呈酸性,Al(OH)3碱性弱比一水合氨碱性弱,则AlCl3水解程度大,酸性强;KCl溶液呈中性;KAlO2溶液呈碱性,
则四种溶液的酸性由强到弱的顺序为AlCl3、NH4Cl、KCl、KAlO2,所以氢氧化镁的溶解度由大到小的顺序是①②③④,
故选B.
本题解析:
本题难度:简单
3、填空题 (15分)铜及其化合物与生产、生活关系密切。
(1)用新制Cu(OH)2与葡萄糖反应制备Cu2O,该反应中葡萄糖是 (填“氧化剂”或“还原剂”)
(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4若将该反应设计成原电池,
正极的电极反应式为
(3)用NH4NO3氧化海绵铜(含Cu和CuO)生产CuCl的部分流程如下:
①步骤I中,反应温度不宜过高的原因是 。
②步骤I中,0.5 mol NH4NO3参加反应有4mol电子转移,铜参与反应的离子方程式为 。
③步骤II中,物质X可选用的物质是 。(填序号)。
a.Cu b.C12 c.H2O2 d.(NH4)2SO3
④步骤II中物质X需要过量的原因,其一是加快反应速率,其二是 _。
⑤步骤II中当NH4 Cl加到一定的量时,生成CuCl 会部分溶解生成CuCl2-在一定温度下建立两个平衡:
Cu Cl(s)  Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu Cl(s) + Cl一(a q) CuCl2(a q) K=0.35
CuCl2(a q) K=0.35
分析[Cu+]、[CuCl2-]和Ksp,K的数学关系,在图中画出「Cu+]、[CuCl2]-的关系曲线(要求至少标出坐标点)
参考答案:(1)还原剂 (2)H2O2+2e-+2H+=2H2O
(3)①防止产生氮氧化物造成污染
②4Cu+NO3-+10H+=4Cu2++NH4++3H2O ③ad ④防止CuCl被氧化
⑤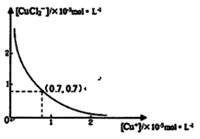
本题解析:(1)用新制Cu(OH)2与葡萄糖反应制备Cu2O,铜元素由+2价得电子生成+1价的Cu2O,作氧化剂,该反应中葡萄糖是还原剂。
(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4,若将该反应设计成原电池,铜失电子做负极,正极是H2O2得电子生成水,则正极的电极反应式为H2O2+2e-+2H+=2H2O。
(3)①硝酸铵受热分解生成氮氧化物,所以步骤I中,反应温度不宜过高的原因是防止产生氮氧化物造成污染,②用NH4NO3氧化海绵铜,铜失电子,NO3-得电子,0.5 mol NH4NO3参加反应有4mol电子转移,说明1molNO3-得8mol电子,氮元素由+5价降低到—3价,所以铜参与反应的离子方程式为4Cu+NO3-+10H+=4Cu2++NH4++3H2O,③步骤II是将硫酸铜还原成CuCl,铜元素由+2价降低到+1价,做氧化剂,需加入具有还原性的物质,且不引入杂质,a. Cu 和d. (NH4)2SO3具有还原性,能达到要求,b. C12和c. H2O2都具有强氧化性,不符,所以物质X可选用的物质是ad,④CuCl很不稳定,容易被氧化,步骤II中物质X需要过量的原因,其一是加快反应速率,其二是防止CuCl被氧化,
⑤根据①Cu Cl(s)  Cu+(a q) + Cl-(a q) Ksp=1.4x10-6, ② Cu Cl(s) + Cl一(a q)
Cu+(a q) + Cl-(a q) Ksp=1.4x10-6, ② Cu Cl(s) + Cl一(a q) [CuCl2]-1(a q) K=0.35 ,①+②得2Cu Cl(s)
[CuCl2]-1(a q) K=0.35 ,①+②得2Cu Cl(s)  Cu+(a q)+ [CuCl2]-(a q) K=0.49×10-6,根据方程式可知:c(Cu+)·c([CuCl2]-)=0.49×10-6,两离子浓度成反比,两离子浓度相同时为0.7×10-3mol/L,据此可画出图像为:
Cu+(a q)+ [CuCl2]-(a q) K=0.49×10-6,根据方程式可知:c(Cu+)·c([CuCl2]-)=0.49×10-6,两离子浓度成反比,两离子浓度相同时为0.7×10-3mol/L,据此可画出图像为:
考点:考查葡萄糖的化学性质,用NH4NO3氧化海绵铜(含Cu和CuO)生产CuCl的工艺流程,化学图像的绘制。
本题难度:困难
4、简答题 用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、Mg2+、Ca2+、Cu2+等)制备氯化锌的一种流程如下:
(1)在反应3前要将菱锌矿研磨,其目的是______.
(2)反应4将Fe2+氧化为Fe3+,该反应的离子方程式为______.
(3)加入氧化锌调节pH=4.5,反应5的离子方程式为______、______.
(4)锌粉不在反应4之前加入的原因是______.
(5)若用石墨作电极电解滤液Y,则可以得到参与本流程反应的物质有______.
参考答案:(1)依据影响化学反应速率的因素分析判断,增大接触面积会增大反应速率,故答案为:增大反应物接触面积,使反应3反应速率加快;
(2)反应1是氯气与氢氧化钠溶液反应,产物是NaClO、NaClO3和水,反应3中加入了过量盐酸,反应4中将Fe2+氧化为Fe3+,反应的离子方程式为:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O,
故答案为:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O;
(3)加入氧化锌调节溶液的pH=4.5,同时得到红褐色沉淀Fe(OH)3,同时不引入新的杂质;反应的离子方程式为:ZnO+2H+═Zn2++H2O,Fe3++3H2O?Fe(OH)3↓+3H+,
故答案为:ZnO+2H+═Zn2++H2O;Fe3++3H2O?Fe(OH)3↓+3H+;
(4)因为菱锌矿中含有杂质离子Fe3+,以及加入的盐酸均可以与锌粉反应,这样锌的用量增加,并造成后续反应中所用的次氯酸钠或氯酸钠的用量也增加,
故答案为:Zn和H+以及Fe3+反应,将增加Zn的用量以及后续实验中次氯酸钠(或氯酸钠)的用量;
(5)滤液Y是ZnCl2,用石墨作电极,电解时首先得到H2和Cl2,当ZnCl2浓度较大时还可以得到Zn,故答案为:H2、Cl2、Zn.
本题解析:
本题难度:一般
5、选择题 查阅资料得知Fe3+、Mg2+、Al3+在浓度均为0.1mol·L-1时,氢氧化物沉淀的pH如下表:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | |
| 开始沉淀的pH | 2.3 | 10.8 | 3.7 | 开始溶解的pH:7.8 |
| 完全沉淀的pH | 4.3 | 12.4 | 5.2 | 完全溶解的pH:10.0 |
参考答案:C
本题解析:根据表中数据可知当要使铁离子完全沉淀,其pH要大于4.3,但此时铝离子也开始沉淀。由于氢氧化铝是两性氢氧化物,根据数据可知当pH大于10.0氢氧化铝即完全溶解。而氢氧化镁只有当pH大于10.8时才能形成沉淀,所以应控制的pH范围是10.0~10.8。答案选C。
本题难度:一般