时间:2017-08-10 00:02:54
1、选择题 下列各组物质中,化学键全部为共价键的是
[? ]
A.NH4Cl CO2 Ne
B.O2 KF SO2
C.HCl CH3CH2OH CH4
D.Na2O2 N2 H2O
2、填空题 A、B、C、D均是1~20号元素,核电荷数依次增大.其中B、C、D的内层电子数为10,原子核外只有一个未成对电子.A原子核外有2个未成对电子.
(1)D离子的电子式是______;
(2)C原子的核外电子排布式为______;
(3)B离子的结构示意图是______;
(4)A元素的元素符号为______.
3、填空题 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).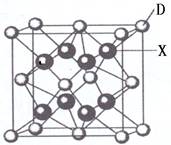
(1)E在周期表中的位置?(指明周期和族)。
(2)A、B、C的第一电离能由小到大的顺序为?.
(3)B的氢化物的分子空间构型是?;AC32-的中心原子采取?杂化.
(4)写出任意一种由两种元素组成的与DC2中的阴离子互为等电子体的微粒的化学式?。
(5)E的高价态离子和低价态离子均能与A、B两元素按原子个数比1:1形成的带一个单位负电荷的阴离子组成六配位的配离子。写出该配离子的化学式??(任写一种).
(6)X是周期表中电负性最大的元素,该元素与D元素组成的离子化合物的晶胞如右图所示。该离子化合物的化学式为?.
4、选择题 下列各组微粒中,不能形成配位键的是
A.Cu2+、H2O
B.Ag+、NH4+
C.Zn2+、 NH3
D.Fe3+、SCN-
5、填空题 在氢气与氯气反应生成氯化氢气体的反应中,若断裂1mol?H-H键要吸收436KJ的能量,断裂1mol?Cl-Cl键要吸收243KJ的能量,断裂1molH-Cl键要吸收432KJ的能量,在氯气中充分燃烧1mol?H2?的能量变化是______.