时间:2017-08-08 06:45:14
1、选择题 已知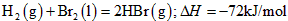 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表
参考答案:D
本题解析:
本题难度:一般
2、选择题 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1
N2(g)+O2(g)═2NO(g)△H=+180kJ?mol-1
则2CO(g)+2NO(g)═N2(g)+2CO2(g)的△H是( ?)
A.-386?kJ?mol-1
B.+386?kJ?mol-1
C.-746?kJ?mol-1
D.+746?kJ?mol-1
参考答案:C
本题解析:
本题难度:一般
3、选择题 已知31g红磷(P,固体)在氧气中燃烧生成P4O10固体放出738.5kJ热量,31g白磷(P4,固体)在氧气中燃烧生成P4O10固体放出745.8kJ热量.下列判断正确的是( )
A.白磷在氧气中燃烧的热化学方程式是:P4(s)+5O2(g)=P4O10(s)△H=-745.8kJ?mol-1
B.红磷转化成白磷时放出热量
C.红磷比白磷稳定
D.31g红磷中蕴含的能量为738.5kJ
参考答案:C
本题解析:
本题难度:简单
4、填空题 盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列的3个热化学反应方程式:
Fe2O3(s)+3CO(g)==2Fe(s)+3CO2(g) △H= -24.8kJ/mol
Fe2O3(s)+CO(g)== Fe3O4(s)+CO2(g) △H= -15.73kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.4kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_______________________________
参考答案:CO(g)+FeO(s)==Fe(s)+CO2(g) △H=-218.00 kJ/mol
本题解析:
本题难度:一般
5、填空题 利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径.
(1)已知:CH4(g)+2O2?(g)=CO2?(g)+2H2O?(l)△H=-890.3kJ?mol-1?①
H2(g)+1/2O2?(g)=H2O?(l)△H=-285.8kJ?mol-1?②
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1?③
H2O(g)=H2O(l)△H=-44.0kJ?mol-1?④
反应CH4(g)+H2O(g)
? |
参考答案:(1)由CH4(g)+2O2?(g)=CO2?(g)+2H2O?(l)△H=-890.3kJ?mol-1?①,
H2(g)+1/2O2?(g)=H2O?(l)△H=-285.8kJ?mol-1?②,
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1?③,
H2O(g)=H2O(l)△H=-44.0kJ?mol-1?④,
根据盖斯定律可知,①+④-③-②×3可得CH4(g)+H2O(g)?高温?.??CO(g)+3H2(g),
其反应热△H=(-890.3kJ?mol-1)+(-44kJ?mol-1)-(-283.0kJ?mol-1)-(-285.8kJ?mol-1)×2=+206.1kJ/mol,
标准状况下33.6L甲烷,其物质的量为1.5mol,所以该反应中转移的电子数为1.5mol×(2+4)=9mol,
该反应放出的热量为1.5mol×206.1kJ/mol=309.15kJ,
故答案为:+206.1;9;309.15;
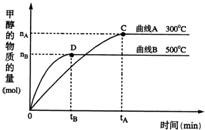
(2)①由CO(g)+2H2(g)?CH3OH(g),则平衡常数K=c(CH3OH)c(CO)?c2(H2),由图可知,温度高时甲醇的量少,则该反应为放热反应,降低温度,平衡正向移动,所以K增大,
故答案为:c(CH3OH)c(CO)?c2(H2);增大;
②由图可知,甲醇在0~tA时间内增加nAmol,则甲醇的反应速率为nA/5tA?mol?(L?min)-1,再由化学计量数之比等于反应速率之比,所以氢气的反应速率为2nA/5tA?mol?(L?min)-1,故答案为:2nA/5tA?mol?(L?min)-1;
③a.CH3OH的生成速率与CO的消耗速率相等,只能确定正反应速率,不能确定正逆反应速率的关系,则不能判断平衡,故a错误;
b.该反应为反应前后压强不等的反应,则容器中气体的压强不变,达到平衡状态,故b正确;
c.因质量、体积不变,则容器中混合气体的密度始终保持不变,不能作为判断平衡的方法,故c错误;?
d.CO百分含量保持不变,浓度不再变化,达到平衡状态,故d正确;
e.CO和CH3OH浓度相等,取决于起始量,不一定达到平衡,故e错误;
故答案为:bd;
④a.体积不变,向容器中再充入Ar,反应体系中各物质的浓度不变,平衡不移动,故a错误;?
b.改变反应的催化剂,不影响化学平衡移动,故b错误;
c.向容器中再充入CO,平衡正向移动,提高氢气的转化率,故c正确;?
d.升高温度提高,平衡逆向移动,H2的转化率减小,故d错误;
故答案为:c.
本题解析:
本题难度:一般