时间:2017-08-08 06:41:27
1、选择题 重水(D2O)的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lgc(D+),以下关于pD的叙述正确的是
A.重水的pD=7.0
B.含0.01mol NaOD的D2O溶液1L,其pD=12.0
C.溶解0.01molDCl的D2O溶液10L,其pD=2.0
D.在100mL 0.25mol/L的DCl重水溶液中,加入50mL 0.2mol/L NaOD的重水溶液,其pD=1.0
参考答案:D
本题解析:略
本题难度:一般
2、选择题 下列各溶液中,pH最大的是(?)
A.pH=9的氨水稀释1 000倍
B.pH=9的烧碱溶液稀释1 000倍
C.pH=5的盐酸稀释1 000倍
D.pH=5的氯化铵溶液稀释1 000倍
参考答案:A
本题解析:C、D两项无论怎么变化pH也不会超过7;pH相同的强碱和弱碱,当稀释相同倍数时,强碱的pH变化大些,弱碱的pH变化要小些,所以A项符合题意。
本题难度:一般
3、填空题 某地的酸雨中,含c (Na+) = 7.0×10-6mol/L,c (Cl-) = 4.5×10-5 mol/L,c (NH4+) = 2.3×10-5 mol/L,c (SO42-) = 2.5×10-6 mol/L,则该地酸雨的pH约为?。.
参考答案:4.7
本题解析:根据电荷守恒可知,氢离子浓度是4.5×10-5 mol/L+2.5×10-6 mol/L×2-7.0×10-6mol/L-2.3×10-5 mol/L=2.4×10-5 mol/L,所以pH=4.7。
本题难度:一般
4、选择题 常温下,用 0.1000 mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L CH3COOH溶液所得滴
定曲线如图。下列说法不正确的是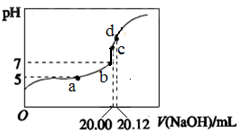
A.a点所示溶液中:c(Na+)=c(CH3COOH) + c(CH3COO-)
B.b和c点所示溶液中:c(OH-)-c(H+)=c(Na+)-c(CH3COO-)
C.d点所示溶液中:c(Na+) >c(CH3COO-) >c(OH-) >c(H+)
D.滴定过程中可能出现:c(CH3COOH) >c(CH3COO-) >c(H+)> c(Na+)>c(OH-)
参考答案:A
本题解析:A、a点时氢氧化钠不足,所示溶液是醋酸钠和醋酸的混合液,所以c(Na+)<c(CH3COOH) + c(CH3COO-),错误;B、b、c对应的溶液中都含有H+、OH-、Na+、CH3COO-,根据电荷守恒,得c(OH-) +c(CH3COO-)=c(Na+)+c(H+),即? c(OH-)-c(H+)=c(Na+)-c(CH3COO-),正确;C、d点时氢氧化钠过量,所示溶液为氢氧化钠与醋酸钠的混合液,溶液呈碱性,所以c(Na+) >c(CH3COO-) >c(OH-) >c(H+) ,正确;D、刚刚滴入很少量的氢氧化钠溶液时,溶液中可能出现c(CH3COOH) >c(CH3COO-)>c(H+)>c(Na+)>c(OH-),正确,答案选A。
本题难度:一般
5、选择题 下列溶液一定呈中性的是
A.溶液中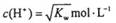 (KW为溶液所处温度时水的离子积常数)
(KW为溶液所处温度时水的离子积常数)
B.pH=7的溶液
C.使石蕊试液呈紫色的溶液
D.等体积0.1 mol·L-1硫酸与0.1 mol·L-1的氢氧化钠溶液混合后的溶液
参考答案:A
本题解析:B项:在常温下,pH=7的溶液呈中性,如其它温度,则不呈中性,故错;C项:使石蕊试液呈紫色的溶液,不一定呈中性,在常温下,pH=5~8都是紫色的,故错;D项:酸的量多,最终溶液呈酸性,故错。故选A。
点评:本题考查的是溶液的酸碱性的判断,题目难度适中,需要注意的是在中性溶液中,c(H+)=c(OH-)。
本题难度:简单