时间:2017-08-08 06:35:29
1、选择题 在同温同压下,下列各组热化学方程式Q2>Q1的是( )
A.2H2(g) + O2(g)=2H2O(l);△H=-Q1 2H2(g) + O2(g)=2H2O(g);△H=-Q2
B.S(g) + O2(g)=SO2(g);△H=-Q1 S(s) + O2(g)=SO2(g);△H=-Q2
C.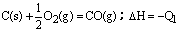 C(s) + O2(g)=CO2(g);△H=-Q2
C(s) + O2(g)=CO2(g);△H=-Q2
D.H2(g) + Cl2(g)=2HCl(g);△H=-Q1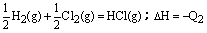
参考答案:C
本题解析:反应放出或吸收的热量的多少,跟反应物和生成物的聚集状态有密切关系。A中两式仅生成物中水的状态不同,由于生成液态水比生成气态水放热多,所以Q1>Q2;B中两式仅硫的状态不同,由于固态硫变成气态硫要吸收热量,所以Q1>Q2;C中固态碳与氧气完全反应生成二氧化碳,放出的热量Q2应大于不完全燃烧时生成一氧化碳放出的热量Q1;D中二式各物质的量不同,有Q1=2Q2的关系,故本题的答案应为C。
考点:考查反应热的有关判断
点评:该是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力和方法的培养与训练,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确影响反应热大小的因素,然后结合题意灵活运用即可。
本题难度:简单
2、选择题 下列叙述正确的是
A.生成物总能量一定低于反应物总能量
B.酒精可用作燃料,说明酒精燃烧是放热反应
C.硝酸铵溶于水温度降低,这个变化是吸热反应
D.同温同压下,H2和Cl2在光照和点燃条件下的ΔH不同
参考答案:B
本题解析:A、放热反应中生成物总能量一定低于反应物总能量,而吸热反应中正好相反,A错误;B、可燃物燃烧均是放热反应,B正确;C、硝酸铵溶于水是物理变化,不是吸热反应,C错误;D、反应热只与反应物总能量和生成物总能量的相对大小有关系,与反应条件无关,D错误,答案选B。
考点:考查反应热的有关判断
本题难度:一般
3、选择题 中和热测定实验中,下列操作会使测得的△H数值偏大的是
A.大烧杯上没有盖硬纸板
B.用环形铜丝搅拌棒代替环形玻璃搅拌棒
C.用相同浓度和体积的硝酸代替稀盐酸溶液进行实验
D.用1gNaOH固体代替50mL0.5mol/L的NaOH溶液进行实验
参考答案:D
本题解析:A和B均会使反应中放出的热量损失,从而使测得的反应热偏小。C不影响。D中氢氧化钠固体溶于水会放热,因此测得的反应热偏大。答案选D。
本题难度:简单
4、填空题 (8分)如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题: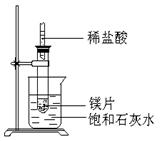
(1)实验中观察到的现象是
。
(2)产生该现象的原因
(3)写出有关反应的离子反应方程式
(4)由此推知,MgCl2溶液和H2的总能量 填(“大于”“小于”或“等于”)镁片和盐酸的总能量
参考答案:(1)向镁片表面产生气泡,逐渐减少;烧杯中有固体物质析出.
(2)镁跟盐酸反应产生氢气,并放出热量;Ca(OH)2的溶解度随温度的升高而变小.
(3)Mg+2H+
本题解析:
本题难度:一般
5、选择题 能正确表示下列反应的离子方程式是
A.用铜片作阴、阳极电解硝酸银溶液:4Ag++2H2O4Ag+O2↑+4H+
B.足量铁与稀硝酸反应:Fe+4H++NO3-=Fe2++2H2O+NO↑
C.向Na2SO3、NaI的混合溶液中滴加少量氯水:2I-+C12═2Cl-+I2
D.等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++OH-+SO42-+H+=BaSO4↓+H2O
参考答案:D
本题解析:分析:A、铜做电极时阳极发生反应是铜失电子发生氧化反应,溶液中的银离子得电子发生还原反应;
B、离子方程式中的电荷不守恒,转移电子不守恒;
C、混合溶液中亚硫酸根离子和碘离子的还原性不同,氧化还原反应先氧化还原性强的离子;
D、等物质的量酸式盐和碱反应依据氢离子和氢氧根离子的反应实质分析判断.
解答:A、用铜片作阴、阳极电解硝酸银溶液阳极电极反应是Cu-2e-=Cu2+,阴极反应为:2Ag++2e-=2Ag,电池反应为Cu+2Ag+=2Ag+Cu2+,故A错误;
B、足量铁与稀硝酸反应:3Fe+8H++2NO3-=3Fe2++4H2O+2NO↑,故B错误;
C、溶液中离子的还原性SO32->I-,通入少量氯气先氧化亚硫酸根离子,离子方程式为:Cl2+SO32-+H2O=SO42-+2H++2Cl-,故C错误;
D、等物质的量的Ba(OH)2与NaHSO4在溶液中反应的离子方程式为:Ba2++OH-+SO42-+H+=BaSO4↓+H2O,故D正确;
故选D.
点评:本题考查了离子方程式的书写原则和注意问题,主要是电解池中的反应离子方程式书写,氧化还原反应的顺序氧化,关键是电解时阳极是活性电极时,电极本身失电子发生氧化还原反应.
本题难度:一般