时间:2017-08-08 06:25:56
1、选择题 下列实验目的可以达到的是
A.电解熔融氯化镁制取金属镁
B.醋酸钠结晶水合物与碱石灰共热制取甲烷。
C.浓硫酸与溴化钠共热制取溴化氢
D.饱和碳酸钠溶液除去二氧化碳中的氯化氢
参考答案:A
本题解析:略
本题难度:一般
2、实验题 某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质是___________________。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管 中的现象分别为:B___________________,D__________________。
(3)装置C的作用是____________________________________________________。
(4)该实验小组的甲、乙两位同学利用上述两发生装置下图装置继续进行实验: 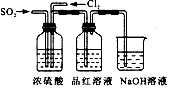
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸的两个目的:___________________________、___________________________。
②试分析甲同学实验过程中,品红溶液不褪色的原因是:____________________________。 (结合离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?_______________________________________________________。
参考答案:(1)酸性、还原性
(2)B溶液恢复红色;D溶液仍无色
(3)吸收多余的SO2和Cl2,防止污染空气
(4)①使SO2和Cl2混合均匀;通过观察气泡控制气体的流速
②控制SO2和Cl2按物质的量之比1:1进气,二者发生反应,生成无漂白性的H2SO4和HCl,SO2+Cl2+2H2O=SO42-+2C1-+4H+
③控制SO2和Cl2进气的物质的量,使二者不相等
本题解析:
本题难度:一般
3、选择题 下列实验设计和结论不相符的是
A.某无色无味气体通入澄清石灰水中,石灰水变浑浊,则该气体为CO2
B.某气体能使湿润的红色石蕊试纸变蓝,则该气体水溶液显碱性
C.某无色溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀,则该溶液中一定有SO42-
D.用可见光束照射某红褐色液体产生丁达尔现象,则该液体为胶体
参考答案:C
本题解析:某无色溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀,则白色沉淀可能是硫酸钡,也可能是氯化银,因此选项C是错误的,其余都是正确的,答案选C。
本题难度:简单
4、实验题 亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及生成气体产物的成分。已知:
①NO+NO2+2OH-=2NO2-+2H2O
②气体液化的温度:NO2? 21℃、NO?-152℃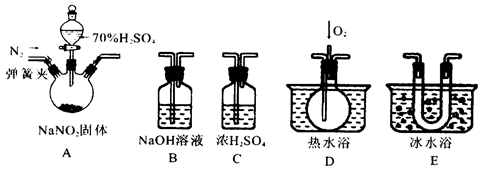
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→C→_______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体.
①确认A中产生气体含有NO,依据的现象是_____________________________.
②装置E的作用是_______________________________________________________
(3)如果向D中通入过量O2,则装置B中发生反应的化学方程式为________________.
如果没有装置C,对实验结论造成的影响是______________________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)?△H=-867kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?△H=-1160kJ·mol-1
则CH4将NO2还原为NO的热化学方程式为:___________________________.
参考答案:
(1)E D B(2分);检验装置的气密性(1分)? (2)①D中出现红棕色气体(2分)? ②冷凝,使NO2完全液(2分)(3)4NO2+O2+4NaOH=4NaNO3+2H2O(2分)?水会与NO2反应产生NO,影响NO的确定(2 分)
(4)2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O(2分)
(5) CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H=-574kJ·mol-1(2分)
本题解析:本题是实验题。实验题是同学们的难点。也是最难得分的题型。对于实验题,首先需看清楚实验目的是什么。在结合看清实验流程,实验操作,物质检验等知识会穿插其中。这题是一道实验探究题,探究NaNO2与H2SO4的反应。从所给装置中,A显然是发生装置。B是NaOH溶液,可能是除杂装置,C是浓硫酸,显然是干燥装置。D是热水浴,并通入了O2,需要通O2检验的是NO气体。E是冷水浴装置。显然是冷却物质。由题中所给2个信息,第一个信息是NO与NO2的混合气体与NaOH发生归中反应。第二个信息是NO、NO2两种气体的物理性质。从液化的温度来看,显然NO2比NO更易液化。A中三颈瓶,采用固液不加热反应,还有一个弹簧夹用来控制通氮气,显然要氮气,目的应是排除氧气。因氧气有氧化性。可能会对实验结果产生干扰。通过上述信息就可以猜测出产生的两种气体可能是NO和NO2。
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):
A是发生装置,C是干燥除去水,NO和NO2的分离,先分离NO2因为更易液化。所以接E,NO2分离后再检验NO,需通氧气。接D。观察到气体从无色变成红棕色。所以说明是NO。B是尾气处理。吸收反应后剩余的NO和NO2的混合气体。在这里存在几个先后问题,首先NO和NO2的检验,根据液化温度判断得到NO2更易液化,可以观察到E中有红棕色液体产生。而后NO会和氧气生成NO2。对于NO2的检验会产生干扰。所以先检验NO2。还有一问题就是除水,如果不除去水的话,NO2会与H2O反应生成NO,所以又会对NO的检验产生干扰,同时也影响NO2的检验。还有一问题就是在A中药品反应之前需通氮气将O2排出来。否则也会影响NO和NO2的检验。装置连接好之后,就是检查装置气密性。
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体。说明生成了NO2气体。
①确认A中产生气体含有NO,是在D装置中通O2来检验的。观察气体是否变红棕色。
②装置E的作用是冷凝,是使NO2完全液化。
(3)如果向D中通入过量O2,不存在NO剩余,但有过量的O2会与NO2发生氧化还原反应,O2降低,NO2升高,所以可推断出反应方程式为:4NO2+O2+4NaOH=4NaNO3+2H2O。如不干燥,水会与NO2反应产生NO,影响NO的确定。
(4)通过上述实验探究过程,可得出装置A中反应应产生两种气体。+3价氮元素发生歧化反应。化学方程式是2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O。
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)?△H=-867kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?△H=-1160kJ·mol-1
根据盖斯定律上式×2-下式可得出:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H=-574kJ·mol-1(2分)
本题难度:一般
5、选择题 在配制一定物质的量浓度的NaOH溶液时,下列情况会造成所配溶液的浓度偏高的是B
A.所用NaOH已经潮解
B.定容时观察液面仰视
C.有少量NaOH溶液残留在烧杯里
D.称NaOH时,砝码已生锈
参考答案:D
本题解析:略
本题难度:一般