时间:2017-08-08 06:18:36
1、选择题 把A、B、C、D?4块金属片浸入稀硫酸中,用导线两两相连组成原电池.若A、B相连时,A为负极;C、D相连时,D上产生大量气泡;A、C相连时,电流由C经导线流向A;B、D相连时,电子由D经导线流向B,则此4种金属的活动性由强到弱的顺序为( )
A.A>B>C>D
B.A>C>D>B
C.C>A>B>D
D.B>A>C>D
参考答案:A、B相连时,A为负极,活泼金属作负极,所以A的金属活动性大于B;
C、D相连时,D上产生大量气泡,D上得电子发生还原反应,所以C上失电子发生氧化反应,故C的金属活动性大于D;
A、C相连时,电流由C经导线流向A,电流由正极流向负极,所以A作负极C作正极,A的金属活动性大于C;
B、D相连时,电子由D经导线流向B,电子的流向与电流的流向相反,由负极流向正极,所以D是负极,B是正极,D的金属活动性大于B,
所以A、B、C、D?4块金属的活动性由强到弱的顺序为A>C>D>B.
故选B.
本题解析:
本题难度:简单
2、填空题 铅蓄电池其电极分别是Pb、PbO2,电解质是一定浓度的硫酸,工作时的反应方程式为:PbO2+Pb+2H2SO4=2PbSO4+2H2O试分别写出其电极反应式。请写出放电时的电极反应。
参考答案:负极:Pb+SO42--2e=PbSO4正极:PbO2+4H++SO42-+2e—=PbSO4+2H2O
本题解析:在负极Pb失去电子,发生氧化反应;在正极PbO2得到电子,发生还原反应。
本题难度:简单
3、选择题 铜锌原电池如图工作时,下列叙述正确的是 
A 正极反应为:Zn—2e-=Zn2+?
B电池总反应为:Zn+2H+=Zn2+ + H2↑
C 盐桥主要作用是形成回路、中和两极电荷
D 盐桥中的Cl—移向CuSO4溶液?
参考答案:C
本题解析:略
本题难度:一般
4、选择题 如图所示,X为单质硅,Y为金属铁,a为NaOH溶液,组装成一个原电池,下列说法中正确的是( )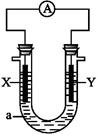
A.X为负极,电极反应为:Si-4e- Si4+
Si4+
B.X为正极,电极反应为:4H2O+4e- 4OH-+2H2↑
4OH-+2H2↑
C.X为负极,电极反应为:Si+6OH--4e- Si+3H2O
Si+3H2O
D.Y为负极,电极反应为:Fe-2e- Fe2+
Fe2+
参考答案:C
本题解析:硅、铁、NaOH溶液组成原电池时,Si为负极:Si-4e-+6OH- Si+3H2O;铁为正极:4H2O+4e-
Si+3H2O;铁为正极:4H2O+4e- 4OH-+2H2↑,总反应:Si+2NaOH+H2O
4OH-+2H2↑,总反应:Si+2NaOH+H2O Na2SiO3+2H2↑。
Na2SiO3+2H2↑。
本题难度:一般
5、填空题 近年来我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:?
①? N2(g)+O2(g)=2NO(g)?△H=+180.5kJ/mo1
②?2C(s)+O2(g)=2CO(g)?△H=-221.0kJ/mo1
③? C(s)+O2(g)=CO2(g)?△H=-393.5kJ/mo1
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=?。
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表: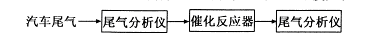

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响);
①前2s内的平均反应速率v(N2)=?。
②在该温度下,反应的平衡常数K=?L·mo1-1(写出计算结果)。
③对于该可逆反应,通过综合分析以上信息,至少可以说明?(填字母)
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量较小
D.该反应在一定条件下能自发进行
E.该反应使用催化剂意义不大
(3)为节约能源,减少污染,该研究小组继续探究一种高铁电池,这是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为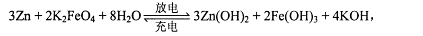
该电池放电时负极反应式为?,每有1mo1K2FeO4被还原,转移电子的物质的量为?,充电时阳极反应式为?。
参考答案:(14分)(1)-746.5kJ/mol(2分)?(2)①1.88×10-4mol/(L·s) (2分) ②5000(2分)
③BCD(2分)(多选、错选均不给分,选对1个得1分)
(3)Zn+2e-+2OH-=Zn(OH)2(或Zn+2OH-→Zn(OH)2+2e-) (2分);3mol(2分)
Fe(OH)3-3e-+5OH-=FeO42-+4H2O(2分)(或Fe(OH)3+5OH-→FeO42-+4H2O+3e-)
本题解析:(1)根据盖斯定律可知,③×-①-②即得到2NO(g)+2CO(g)=N2(g)+2CO2(g) ,所以该反应得反应热△H=-393.5kJ/mol×-180.5 kJ/mol+221 kJ/mol=-746.5kJ/mol,
(2)①根据表中数据可知,前2s则NO浓度减少了(10.0-2.50)×10-4mol/L=7.50×10-4mol/L,则根据方程式可知生成氮气得浓度是7.50×10-4mol/L÷2=3.75×10-4mol/L,所以氮气得反应速率是3.75×10-4mol/L÷2s=1.88×10-4mol/(L·s)。
②根据表中数据可知,反应进行到4s时,达到平衡状态。此时NO和CO浓度分别是1.00×10-4mol/L和2.70×10-3mol/L,生成物氮气和CO2的浓度是(10.0-1.00)×10-4mol/L÷2=4.50×10-4mol/L、10.0-1.00)×10-4mol/L=9.00×10-4mol/L,所以该温度下的平衡常数K=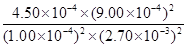 =5000。
=5000。
③A、反应是放热反应,则生成物的总能量低于反应物的总能量。能量越低越稳定,则生成物的稳定性强,A不正确;B、根据表中数据可知,反应进行到4s时,达到平衡状态,这说明该反应一旦发生将在很短的时间内完成,B正确;C、由于平衡常数很大,K=5000,这说明反应物的转化率很高,因此该反应体系达到平衡时至少有一种反应物的百分含量较小,C正确;D、由于该反应是放热反应,因此该反应在一定条件下能自发进行,D正确;E、催化剂虽然不能改变平衡状态,但可以加快反应速率,所以E不正确,答案选BCD。
(3)原电池中负极失去电子,则根据总的反应式可知,锌是负极,失去电子生成氢氧化锌,则负极电极反应式是Zn+2e-+2OH-=Zn(OH)2;根据反应的方程式可知,反应前铁的化合价是+6价,反应后降低到+3价,得到3个电子,则每有1mo1K2FeO4被还原,转移电子的物质的量为3mol;充电时阳极失去电子,化合价升高,发生氧化反应,所以根据反应式可知,阳极是氢氧化铁失去电子,生成高铁酸钾,则阳极电极反应式为Fe(OH)3-3e-+5OH-=FeO42-+4H2O。
本题难度:困难