时间:2017-08-08 06:13:50
1、填空题 (9分)铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是__________________________.
(2)铝与氢氧化钾溶液反应的离子方程式是?.
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.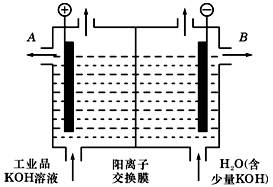
①该电解槽的阳极反应式是___________________.
②通电开始后,阴极附近溶液pH会增大,请简述原因__________ .
③除去杂质后的氢氧化钾溶液从出口______(填写“A”或“B”)导出。
参考答案:
(9分)(1)2Al2O3?===4Al+3O2↑
(2)2Al+2OH—+2H2O==2AlO2—+3H2↑
或2Al+2OH—+6H2O ===2[Al(OH)4]—+3H2↑]?
(3)①4OH- -4e- = 2H2O+O2↑
②因在阴极上发生电极反应为:2H++2e- =?H2↑,使c(H+)减小,c(OH—)增大,故pH增大。?③B
本题解析:略
本题难度:简单
2、计算题 将镁、铝的混合物7.8 g溶于100 mL 6 mol/L的H2SO4溶液中,然后再滴加2 mol/L的NaOH溶液。请回答: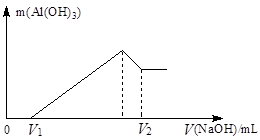
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液的体积V变化如下图所示。当V1=200 mL时,则金属粉末中,n(Mg)=_________mol,V2=__________mL。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、A13+刚好沉淀完全,则滴入NaOH溶液的体积为__________mL。
参考答案:(本题5分)(1)0.1? 700?(2)600
本题解析:(1)由图像可知:V1 mL的NaOH溶液是与过量H2SO4反应的,则与Mg、
Al反应的为H2SO4的物质的量是0.6mo-2mol×0.2L÷2=0.4mol
设混合物中镁和铝的物质的量n(Mg)=x mol,n(Al)=y mol
则x+1.5y=0.4mol、24x+27y=7.8g
解得x=0.1mol、y=0.2mol
当加入V2 mL NaOH溶液时,得到Mg(OH)2沉淀和NaAlO2
关系式为: Mg2+~2OH-,Al3+~4OH-,
则V2=200 mL+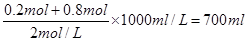
(2)当Mg2+、Al3+刚好沉淀完全时,溶液中只有Na2SO4
关系式为2NaOH~H2SO4
则滴入NaOH溶液的体积为V(NaOH)=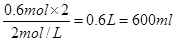
点评:该题是中等难度的试题,试题贴近高考,基础性强,难易适中,侧重对学生能力对培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和规范的答题能力。也有助于提升学生的学科素质,提高学生分析问题、解决问题的能力。该题的关键是明确反应的原理,然后结合图像信息具体问题、具体分析即可。
本题难度:一般
3、选择题 将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示。.则下列说法不正确的是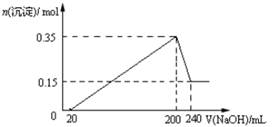
A.镁和铝的总质量为9 g
B.最初20 mLNaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
参考答案:D
本题解析:由图象可知,NaOH溶液0~20mL,发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O;20~200mL发生的反应为:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓;200~240mL,发生的反应为:Al(OH)3+OH-=AlO2-+2H2O;当NaOH溶液200mL时,沉淀量最大,此时沉淀为Mg(OH)2和Al(OH)3,二者物质的量之和为0.35mol,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)=1/2n(NaOH);所以n(Na2SO4)=1/2×0.2L×5mol/L=0.5mol,所以硫酸的浓度为2.5mol/L;当NaOH溶液240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol,由元素守恒可知n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol,所以镁和铝的总质量为0.2mol×27g/mol+0.15mol×24g/mol=9g;根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg)=3×0.2mol+2×0.15mol=0.9mol,所以n(H2)=0.45mol,故氢气体积为0.45mol×22.4mol/L=10.08L。
本题难度:一般
4、选择题 下列物质的转化在给定条件下能实现的是
①SiO2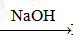 Na2SiO3
Na2SiO3 H2SiO3? ②Fe
H2SiO3? ②Fe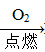 Fe2O3
Fe2O3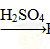 Fe2(SO4)3
Fe2(SO4)3
③BaSO4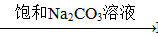 BaCO3
BaCO3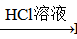 BaCl2 (Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=2.6×10-9)
BaCl2 (Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=2.6×10-9)
④AlCl3溶液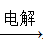 Al
Al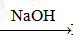 NaAlO2
NaAlO2
⑤HCHO HCOOH
HCOOH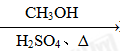 HCOOCH3
HCOOCH3
A.①②⑤
B.②③④
C.②④⑤
D.①③⑤
参考答案:D
本题解析:①正确;铁燃烧生成四氧化生铁,得不到氧化铁,②不正确;只要溶液中c(Ba2+)·c(CO32-)>Ksp(BaCO3)即可形成碳酸钡沉淀,因此硫酸钡能溶于饱和的碳酸钠溶液中生成碳酸钡,③正确;电解氯化铝溶液生成氯气、氢气和氢氧化铝,④不正确;⑤正确,答案选D。
本题难度:一般
5、选择题 某同学用回收的镁铝合金制取氢气。现有10.8 g镁铝合金,下列说法正确的是(?)
A.常温下与足量18mol/LH2SO4反应,最多可放出0.6 mol H2
B.常温下与足量2mol/LHNO3反应,最少可放出0.45 mol H2
C.常温下与足量2 mol/L H2SO4反应,放出H2的量在0.45 mol~0.6 mol之间
D.常温下与足量2mol/LNaOH反应,放出H2的量在0.45 mol~0.6 mol之间
参考答案:C
本题解析:略
本题难度:简单