时间:2017-08-08 06:03:30
1、选择题 有镁和铝的混合物粉末溶于4 mol·L-1的盐酸500 mL中,若加入2 mol·L-1的NaOH溶液,使产生的沉淀质量最大,则需加入NaOH的体积为
A.100 mL
B.500 mL
C.1 000 mL
D.1 500 mL
参考答案:C
本题解析:
本题难度:一般
2、选择题 温度一定时,用水稀释0.1mol/L氨水时,溶液中随着加水量的增加而减小的是
A.c(OH-)
B.c(OH-)/c(NH3·H2O)
C.c(H+)和c(OH-)的乘积
D.OH-的物质的量
参考答案:A
本题解析:稀释碱液,碱性减弱,c(OH-)减小。根据电离平衡常数可知,c(OH-)/c(NH3·H2O)
增大。c(H+)和c(OH-)的乘积只与温度有关,温度一定时其乘积一定。稀释促进电离,平衡正向移动,所以OH-的物质的量增大,但浓度减小。故选A
本题难度:一般
3、选择题 把pH=2的H2SO4和pH=11的NaOH溶液混和,混和液pH=7。则两溶液的体积比是
A.10:1
B.1:10
C.1:2
D.2:1
参考答案:B
本题解析:试题分析:混合后溶液的pH=7, 所以氢离子的物质的量等于OH-的物质的量,即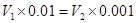 ,解得
,解得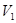 ︰
︰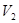 =1:10,答案选B。
=1:10,答案选B。
考点:考查pH的有关计算
点评:在计算溶液的pH时,如果是酸和碱反应,则首先要判断酸和碱的过量问题,如果酸过量,则首先计算溶液中氢离子浓度。如果是碱过量,则首先计算的是溶液中OH-的浓度,然后根据水的离子积常数在换算成氢离子浓度。
本题难度:困难
4、选择题 下列叙述正确的是?
A.在醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B.若1mL pH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7则NaOH溶液的pH=11
C.1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0
D.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
参考答案:B
本题解析:试题分析:醋酸溶液虽然稀释中电离平衡正向移动,但是c(H+)减小,所以b>a,A错误;盐酸和NaOH溶液混合后pH=7,说明酸碱恰好完全反应,则NaOH的pH=11,B正确;1.0×10-8mol/L的盐酸,水电离出的H+大于酸电离的H+,所以溶液的pH接近于7,C错误;酚酞的变色范围是8-10所以溶液呈无色,溶液的pH>7,D错误。答案选B。
考点:弱电解质的电离
点评:本题综合性强,主要考查电离平衡的应用,锻炼学生的分析能力。
本题难度:困难
5、选择题 室温时,向20 mL 0.1 mol/L的醋酸溶液中不断滴入0.1 mol/L的NaOH溶液,溶液的pH变化曲线如图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述正确的是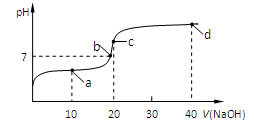
A.a点时:c(CH3COOH) >c(CH3COO-) >c(H+) >c(Na+) >c(OH-)
B.b点时:c(Na+)=c(CH3COO-)
C.c点时:c(H+)=c(CH3COOH)+c(OH-)
D.d点时:c(Na+) >c(OH-) > c(CH3COO-) >c(H+)
参考答案:BD
本题解析:a点时,二者反应后相当于等浓度的CH3COOH与CH3COONa溶液,由于酸的电离大于盐的水解,故: c(CH3COO-)>c(Na+) c(CH3COOH) >c(H+) >c(OH-);
b点时正好呈中性,由电荷守恒可知正确;c点时,二者反应后即是CH3COONa溶液,电荷守恒:c(Na+) + c(H+)= c(CH3COO-) + c(OH-)?①,物料守恒:c(Na+) =c(CH3COOH) + c(CH3COO-) ②,将②代入①式可知:c(OH-)=c(H+)+c(CH3COOH);d点时,二者反应后相当于等浓度的NaOH与CH3COONa溶液,根据物料守恒和电荷守恒即可得出:c(Na+) >c(OH-) > c(CH3COO-) >c(H+)
本题难度:困难