时间:2017-08-08 05:56:29
1、选择题 下列叙述中正确的是
[? ]
A.P4和NO2都是共价化合物
B.CCl4和NH3都是以极性键结合的极性分子
C.在CaO和SiO2晶体中,都不存在单个小分子
D.甲烷的结构式为是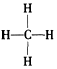 对称的平面结构,所以是非极性分子
对称的平面结构,所以是非极性分子
参考答案:C
本题解析:
本题难度:简单
2、填空题 填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:______;
(2)周期表中最活泼的非金属元素位于第______族;
(3)所含元素种类是8种的周期是第______、______周期.
参考答案:(1)质子数为8的原子为氧原子,则含8个质子、10个中子的原子的质量数=8+10=18,化学符号为188O,
故答案为:188O;
(2)非金属强的元素在元素周期表中的右上方的位置,在每个周期中第ⅦA族元素的非金属性最强,在第ⅦA族中Cl元素的非金属性最强,故答案为:ⅦA;
(3)短周期包括一、二、三周期,第一周期有2种元素,第二、三周期都含有8种元素,故答案为:二;三.
本题解析:
本题难度:一般
3、选择题 下列化合物中既有离子键又有共价键的是( )
A.KBr
B.NH4Cl
C.HF
D.O3
参考答案:B
本题解析:
本题难度:简单
4、填空题 短周期元素ABCD原子序数依次增大.A元素原子核内无中子;B元素原子核外最外层电子数是次外层电子数的2倍;C元素是地壳含量最多的元素;D在短周期元素中金属性最强.请回答:
(1)B在元素周期表中的位置是______.
(2)A与C可形成10电子分子,其化合物类型为______(填“离子”或“共价”)化合物.
(3)A与C还可以形成一种18电子分子,向其溶液中加入少量二氧化锰粉末,反应的化学方程式为______.
(4)D与C按原子个数比为1:1组成的化合物与BC2反应的化学方程式为______.
参考答案:短周期元素A、B、C、D原子序数依次增大.A元素原子核内无中子,则A为H元素;B元素原子核外最外层电子数是次外层电子数的2倍,B原子只能有2个电子层,最外层电子数为4,则B为碳元素;C元素是地壳含量最多的元素,则C为O元素;D在短周期元素中金属性最强,则D为Na,
(1)B为C元素,原子核外有2个电子层,最外层电子数为4,则位于周期表第二周期ⅣA族,
故答案为:第二周期ⅣA族;
(2)H与O可形成10电子分子为H2O,属于共价化合物,
故答案为:共价;
(3)H与O还可以形成一种18电子分子为H2O2,向其溶液中加入少量二氧化锰粉末,H2O2分解生成H2O、O2,反应的化学方程式为:2H2O2MnO2. 2H2O+O2↑,
故答案为:2H2O2MnO2. 2H2O+O2↑;
(4)Na与O按原子个数比为1:1组成的化合物为Na2O2,与CO2反应生成碳酸钠与氧气,化学反应方程式为:2Na2O2+2CO2═2Na2CO2+O2,
故答案为:2Na2O2+2CO2═2Na2CO2+O2.
本题解析:
本题难度:简单
5、选择题 某种元素R的核外电子数等于核内中子数,取该元素5.6g跟氧气充分反应,可得到12g化合物RO2,则该种元素R在周期表中的位置是( )
A.第二周期第ⅣA族
B.第三周期第ⅣA族
C.第三周期第ⅥA族
D.第二周期第ⅥA族
参考答案:该元素5.6g跟氧气充分反应,可得到12g化合物RO2,
由质量守恒定律可知,n(O2)=12g-5.6g=6.4g,则n(O2)=6.4g32g/mol=0.2mol,
反应的方程式应为R+O2=RO2,
则n(R)=0.2mol,M(R)=5.6g0.2mol=28g/mol,
元素R的核外电子数等于核内中子数,
则R的质子数应为14,为Si元素,
位于周期表第三周期第ⅣA族.
故选B.
本题解析:
本题难度:简单