时间:2017-08-08 05:54:39
1、选择题 某原电池装置如右图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂。下列叙述正确的是?(?)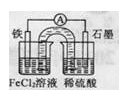
A.原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大
B.此电池工作原理与硅太阳能电池工作原理相同
C.Fe为正极,石墨上发生的反应为:2H++2e-=H2↑
D.原电池装置中的盐桥完全可用金属导线代替
参考答案:A
本题解析:A 正确,铁做负极,阴离子向负极移动,盐桥中的Cl-移向负极,c(Cl-)会增大
B 错误,此电池为原电池,是把化学能转变为电能,硅太阳能电池是把太阳能转变为电能,工作原理不相同
C 错误。Fe为负极,不是正极。
D 错误,盐桥不可用金属导线代替,盐桥是提供离子的通路,金属是电子移动的通路。
本题难度:简单
2、选择题 下列叙述中正确的是( )
A.用铂电极电解NaOH溶液,一段时间后,溶液中溶质的质量分数不变
B.用电解法精炼粗铜时,粗铜作阴极
C.用惰性电极电解100mL饱和食盐水,生成112mL氢气(标况)时,氢氧根离子浓度约为0.05mol/L(假定溶液体积仍为100mL)
D.铜锌原电池工作时,正极从外电路得到电子
参考答案:A、用铂电极电解NaOH溶液时,阳极上氢氧根离子失电子生成氧气,阴极上氢离子得电子生成氢气,导致溶液中氢氧化钠的量不变,水的质量减少,所以一段时间后,溶液中溶质的质量分数增大,故A错误;
B、用电解法精炼粗铜时,粗铜作阳极,精铜作阴极,故B错误;
C、用惰性电极电解100mL饱和食盐水,生成112mL氢气(标况)时,阳极上生成112mL氯气,根据电池反应方程式计算生成的氢氧化钠的物质的量.
设生成氢氧化钠的物质的量为x.
2NaCl+2H2O?电解?.?Cl2↑+H2↑+2NaOH
? 22.4L? 2mol
? 0.112L? x
x=0.01mol,氢氧根离子浓度C=nV=0.01mol0.1L=0.1mol/L,故C错误;
D、铜锌原电池工作时,负极上锌失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿外电路流向正极,所以正极从外电路得到电子,故D正确.
故选D.
本题解析:
本题难度:简单
3、选择题 下图为番茄电池,下列说法正确的是 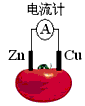
[? ]
A.一段时间后,锌片质量会变小
B.铜电极附近会出现蓝色
C.电子由铜通过导线流向锌
D.锌电极是该电池的正极
参考答案:A
本题解析:
本题难度:一般
4、选择题 LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:
FePO4+Li LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
[? ]
A.可加入硫酸以提高电解质的导电性
B.放电时电池内部Li+向负极移动
C.充电过程中,电池正极材料的质量减少
D.放电时电池正极反应为:FePO4+Li++e-===LiFePO4
参考答案:CD
本题解析:
本题难度:一般
5、填空题 锌锰干电池是普遍使用的化学电源,其中含有MnO2、NH4Cl、ZnCl2等糊状物。以锌筒为负极材料,石墨为正极材料。一节干电池电动势和内电阻分别为g=1.5V,r=0.25Ω,它对外供电时效率 =75%。干电池的工作原理是: Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3↑+ H2O
(1)试写出干电池放电时的正、负极反应式。正极_____________;负极_____________。
(2)正极反应中,前后经历了下列两个反应:2NH4++2e-=2NH3↑+H2↑ 2MnO2+H2=Mn2O2+H2O 如果正极反应没有MnO2的参与,干电池将难以持续稳定工作。试说明理由:____________________________________。
(3)在通电10min内参加反应的MnO2质量约为多少?外电阻消耗的电能是多少?
______________________________
(4)许多国家对废旧电池进行回收,从保护环境和节约能源的角度解释为什么要回收废旧电池?__________________________
参考答案:(1)2MnO2+2NH4++2e-=Mn2O3+2NH3↑+ H2O;Zn-2e-=Zn2+
(2)正极反应中产生的H2附着于石墨上,增加电池内阻
(3)0.813g;1.01×103J
(4)可以回收到大量的金属材料和化工原料。废旧电池中对生态环境有害的物质在自然条件下极难被降解;废旧锌锰干电池含有高浓度的氯化铵溶液,埋在土壤中会使土壤酸化,种子脱水死亡。
本题解析:
本题难度:一般