时间:2017-08-08 05:54:39
1、选择题 右图装置中,所用电极均为惰性电极,通电一段时间后,b极附近溶液呈红色,下列说法中正确的是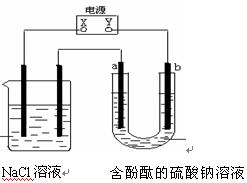
A.X是正极,Y是负极
B.a是正极,b是负极
C.NaCl溶液的pH保持不变
D.NaCl溶液的pH减小
参考答案:A
本题解析:略
本题难度:简单
2、选择题 下列关于原电池的叙述正确的是 (? )
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转化为电能的装置
C.在原电池中,电子流出的一极是负极,该电极被还原
D.原电池放电时,电流的方向是从负极到正极
参考答案:B
本题解析:构成原电池的正、负极可以用金属电极与非金属,如碳作电极,原电池中电子流出的一极发生氧化反应,电流的方向是从正极经外电路流向负极,与电子流动的方向是相反的。
本题难度:一般
3、填空题 (12分)铁在地壳中的含量约占 5 %左右。铁矿石的种类很多,重要的有磁铁矿石
(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等。
(1)红热的铁能跟水蒸气反应,一种产物与磁铁矿的主要成分相同,另一种产物是
可燃性气体,则其反应的化学方程式为 。 该可燃气体在酸性
条件下,可制成燃料电池,写出该气体发生的电极反应式 。
(2)在常温下,铁跟水不起反应。但在潮湿的空气中,铁很容易生锈(铁锈的主要成分是 Fe203)而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。铁生锈的化学原理如下,请你用离子方程式和化学方程式补充完整。
① 原电池反应:
负极:2Fe-4e-=2Fe2+、正极: ;
② 氢氧化物的形成: Fe2 + + 2OH-=" Fe(OH)" 2↓ 。
③ 氢氧化物的分解: 2Fe(OH)3 =Fe2O3+3H2O。
(3)为了防止铁生锈,可在铁制品表面镀上一层铜(如图装置),a为 (填“正极”或“负极”),
铁制品表面发生的电极反应式 为 。
参考答案:(1)3Fe+4H2O Fe3O4+4H2 ; H2—2e-=2H+
Fe3O4+4H2 ; H2—2e-=2H+
(2)①O2+4e-+2H2O=4OH- ,② 4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)正极 , Cu2++2e-="Cu" 。
本题解析:(1)红热的铁能跟水蒸气反应,一种产物与磁铁矿的主要成分相同,为Fe3O4,另一种产物是可燃性气体,为H2,所以化学方程式为:3Fe+4H2O Fe3O4+4H2;酸性条件下,氢气通入燃料电池的负极,电极反应式为:H2—2e-=2H+
Fe3O4+4H2;酸性条件下,氢气通入燃料电池的负极,电极反应式为:H2—2e-=2H+
(2)①正极O2得电子生成OH?,电极方程式为:O2+4e-+2H2O=4OH-
②Fe(OH)2与O2、H2O反应生成Fe(OH)3,化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)在铁制品上镀铜,铁制品为阴极,连接电源的负极,所以a为电源的正极;Cu2+在铁制品表面得电子生成Cu,电极方程式为:Cu2++2e-=Cu。
考点:本题考查原电池原理、电解原理、方程式的书写。
本题难度:困难
4、选择题 关于如图所示装置的叙述,正确的是( )
A.铜为负极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原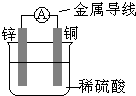
参考答案:由图可知,为Cu、Zn原电池,发生Zn+H2SO4═ZnSO4+H2↑,
A.Cu为正极,表面有气泡产生,故A错误;
B.Cu的质量不变,故B错误;
C.Cu为正极,则电流从铜片经导线流向锌片,故C错误;
D.该反应生成氢气,是因氢离子在铜片表面被还原,故D正确;
故选D.
本题解析:
本题难度:一般
5、填空题 发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:
(1)该过程中产生的的CO可继续与水蒸气发生可逆反应得到CO2和H2,此反应的平衡常数表达式K =____________。
(2)CH3OH(l)气化时吸收的热量为27 kJ/mol,CH3OH(g)的燃烧热为677 kJ/mol,请写出CH3OH(l)完全燃烧的热化学方程式_________________。
(3) “催化还原”反应制乙二醇原理如下:
CH3OOC-COOCH3(g)+4H2(g)  ?HOCH2-CH2OH(g)+2CH3OH(g)?△H =" -34" kJ/mol
?HOCH2-CH2OH(g)+2CH3OH(g)?△H =" -34" kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究。下图表示乙二醇达到平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5 MPa、2.5 MPa、3.5 MPa的情况,则曲线甲对应的压强是P(甲)=___________。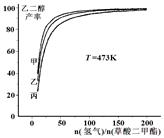
(4)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
① 草酸氢钾溶液中存在如下平衡:
H2O H++OH-、HC2O4-
H++OH-、HC2O4- H++C2O42-和?。
H++C2O42-和?。
② 向0.1 mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是?(填序号)。
a.c(K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-)
b.c(K+) + c(Na+) = c(HC2O4-) + c(C2O42-)
c.c(Na+) = c(H2C2O4) + c(C2O42-)
d.c(K+) > c(Na+)?
(5)以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极反应式为?;若以甲烷代替该燃料电池中的甲醇,向外界提供相等电量,则每代替32 g甲醇,所需标准状况下的甲烷的体积为?L。
参考答案:(14分)
(1)K=
(2)CH3OH(l) +3/2O2(g) = CO2(g)+2H2O(l)?H =" -650" kJ /mol
(3)3.5 MPa
(4)①HC2O4-+H2O H2C2O4+OH-?② a d
H2C2O4+OH-?② a d
(5)CH3OH+H2O-6e-=CO2+6H+? 16.8
本题解析:
(2)① CH3OH(l)= CH3OH(g)?H =" 27" kJ /mol
②CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(g)?H =" -677" kJ /mol
①+② 得 CH3OH(l) +3/2O2(g) = CO2(g)+2H2O(l)?H =" -650" kJ /mol
(3)压强越大,速率越大,达平衡所需的时间越短,甲的时间最短,对应的压强最大,为3.5 MPa
(4)①HC2O4-既有电离又有水解。②a为物料守恒,正确;b为电荷守恒,错误,正确的为c(H+)+c(K+) + c(Na+) = c(HC2O4-) + 2c(C2O42-)+c(OH-);c错误;向0.1 mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,草酸氢钾溶液呈酸性,若草酸氢钾和NaOH溶液恰好反应,生成K2C2O4和Na2C2O4,它们水解呈碱性,要呈中性,应是草酸氢钾>NaOH,即c(K+) > c(Na+),d正确,选a d 。
(5)总:CH3OH+3/2O2= CO2+2H2O?酸性电解质的正极反应式:3/2O2+6 H++6e-="3" H2O?
负极反应式=总-正极反应式?得:CH3OH+H2O-6e-=CO2+6H+
CH4 +2H2O -8e-= CO2+8 H+?,32 g甲醇相当于1mol ,有6 mol电子转移,提供相等电量,需3/4 mol CH4,V="nVm=3/4*22.4=" 16.8(L)
本题难度:困难