时间:2017-08-08 05:51:23
1、填空题 金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为_____________;
(2) NiO、FeO的品体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO_____ FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为______、_______;
(4)金属镍与镧( La)形成的合金足一种良好的储氢材料,其晶胞结构示意图如图1所示,该合金的化学式为_________;
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图2所示。
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是_________,氮镍之间形成的化学键是__________;
②该结构中,氧氢之间除共价键外还可存在_________________;
③该结构中,碳原子的杂化轨道类型有______________。
2、选择题 下列各晶体中,含有的化学键的类型相同且晶体类型也相同的一组是
A.SiO2和SO2
B.SiO2和 NaCl
C.NaCl和 HCl
D.CCl4和CH4
3、选择题 晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如右图所示,下列说法正确的是 (?)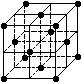
A.C60摩尔质量是720
B.C60属于离子晶体
C.在C60晶胞中有4个C60分子
D.每个C60分子周围与它距离最近等距离的C60分子有12个
4、简答题 下表是元素周期表的一部分.表中所列的字母分别代表某一种化学元素.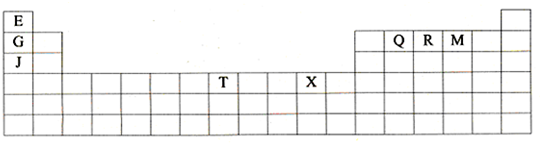
(1)T3+的核外电子排布式是:______
(2)Q、R、M的第一电离能由大到小的顺序是______(用元素符号表示)
(3)下列有关上述元素的说法中,正确的是:______(填序号)
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个π键
(4)加拿大天文台在太空发现了EQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键.写出其结构式:______
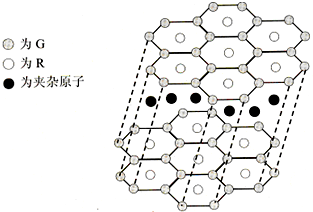
(5)G与R单质直接化合生成一种离子化合物G3R.该晶体具有类似石墨的层状结构.每层中,G原子构成平面六边形,每个六边形的中心有一个R原子.层与层之间还夹杂一定数量的原子.请问这些夹杂的原子应该是______(填G或R的元素符号)
5、选择题 下列说法正确的是
A.原子晶体中只存在非极性共价键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.分子晶体的熔点普遍都很高