时间:2017-08-08 05:49:12
1、选择题 化学与生活密切相关,下列说法不正确的是
A.聚氯乙烯不能做食品包装袋
B.一般情况下,合金的熔点比各成分金属的低,硬度比纯金属大
C.植物通过光合作用将CO2转化为糖是太阳能转变成热能的过程
D.对于酸性废水和碱性废水一般可以采用中和法处理,对于高浓度的酸、碱废水,应优先考虑回收利用
参考答案:C
本题解析:分析:A.根据聚氯乙烯会产生氯化氢气体,所添加的增塑剂、防老剂等主要辅料有毒性进行分析;
B.根据合金的性能和金属的性能比较解答;
C.植物通过光合作用将CO2转化为糖是太阳能转变成化学能;
D.废水中和处理法是废水化学处理法之一种.利用中和作用处理废水,使之净化的方法.
解答:A.聚氯乙烯在包装食品长时间或受热的条件下会分解氯化氢,氯化氢有毒,它所添加的增塑剂、防老剂等主要辅料有毒性,日用聚氯乙烯塑料中的增塑剂,主要使用对苯二甲酸二丁酯、邻苯二甲酸二辛酯等,这些化学品都有毒性,聚氯乙烯的防老剂硬脂酸铅盐也是有毒的,故A正确;
B.合金的硬度一般比组成合金的各成分硬度高,合金的熔点比各成分的熔点低,故B正确;
C.植物通过光合作用将CO2转化为糖是太阳能转变成化学能的过程,故C错误;
D.高浓度的酸、碱废水,应优先考虑回收利用,对于酸性废水和碱性废水一般可以采用中和法处理,故D正确.
故选C.
点评:本题考查聚氯乙烯是有毒的、合金、能量转化形式、废水的处理,难度不大,注意高浓度的酸、碱废水,应优先考虑回收利用.
本题难度:困难
2、选择题 下列说法正确的是
A.淀粉溶于水得到的分散系属于溶液
B.CaF2、Na2S03都含有离子键和共价键,都属于离子化合物
C.S02、Si02既是酸性氧化物也是非金属氧化物
D.从氧化剂和还原剂角度对物质分类,则H202只能属于氧化剂
参考答案:BC
本题解析:分析:A、淀粉水溶液属于胶体;
B、含有离子键的化合物叫做离子化合物;
C、能和碱反应生成盐和水的化合物叫做酸性氧化物;
D、根据双氧水中氧元素化合价是-1价来确定物质具有的性质.
解答:A、淀粉水溶液属于胶体分散系,故A错误;
B、CaF2、Na2S03中含有离子键和共价键,含有离子键的化合物叫做离子化合物,故B正确;
C、二氧化硫和二氧化硅是能和碱反应生成盐和水的化合物,属于酸性氧化物,也属于非金属氧化物,故C正确;
D、双氧水中氧元素化合价是-1价,处于氧元素的中间价态,双氧水既有氧化性又有还原性,故D错误.
故选BC.
点评:本题考查学生物质的分类知识,注意概念的灵活应用是解题的关键,可以根据教材知识来回答,难度不大.
本题难度:简单
3、选择题 火法炼铜首先要焙烧黄铜矿,主要涉及以下反应:
①2CuFeS2+O2=Cu2S+2FeS+SO2
②Cu2S+O2=2Cu+SO2
下列说法正确的是
A.在反应①中:SO2既是氧化产物又是还原产物
B.在反应②中:Cu2S仅作还原剂,硫元素被氧化
C.在反应①中:每转移1.2?mol电子,有0.2?mol硫被氧化
D.在反应②中:每消耗1.0?molCu2S,有4.0?mol电子转移
参考答案:AC
本题解析:分析:A、标注元素化合价变化,依据氧化还原反应的概念分析判断,还原剂被氧化生成氧化产物,氧化剂被还原生成氧化产物;
B、标注化合价分析判断;
C、依据化学方程式和电子守恒、化合价变化计算判断;
D、依据化学方程式和电子守恒、化合价变化计算判断;
解答:A、2CuFeS2+O2=Cu2S+2FeS+SO2中,Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,氧气中O元素由0降低为-2价,则SO2既是氧化产物又是还原产物,故A正确;
B、Cu2S+O2=2Cu+SO2,铜元素化合价从+1价降到0价,氧元素化合价从 0价降低到-2价,硫元素化合价从-2价升高到+4价,则在反应②中:Cu2S即作氧化剂又做还原剂,硫元素被氧化,故B错误;
C、2CuFeS2+O2=Cu2S+2FeS+SO2中,硫元素化合价从-2价升高到+4价,所以生成1molSO2转移电子为6mol,被氧化的硫元素为1mol,每转移1.2 mol电子,有0.2 mol硫被氧化,故C正确;
D、Cu2S+O2=2Cu+SO2,铜元素化合价从+1价降到0价,氧元素化合价从 0价降低到-2价,硫元素化合价从-2价升高到+4价,消耗1molCu2S,电子转移6mol,故D错误;
故选AC.
点评:本题考查了氧化还原反应的概念应用,电子守恒的判断,化合价的升降分析判断概念的应用,转移电子的计算方法.
本题难度:简单
4、选择题 香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下图所示。下列说法正确的是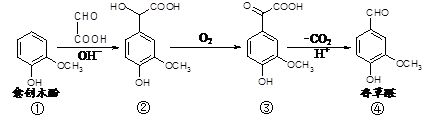
A.在上述三步反应中理论上只有①生成②的反应原子利用率为100%
B.氯化铁溶液和碳酸氢钠溶液都能鉴别①④
C.②③分子内含手性碳原子
D.在氢氧化钠溶液中,①③分别消耗NaOH物质的量之比为1 ∶2
参考答案:A
本题解析:试题分析:A、①生成②是加成反应,原子利用率为100%,其它两步是氧化和还原反应,有其它物质生成,正确;B、①④均可用氯化铁溶液鉴别,但不能与碳酸氢钠溶液反应,错误;C、②中连接羟基和羧基的碳原子为手性碳原子,但③没有,错误;D、①中酚羟基与氢氧化钠反应,③酚羟基、羧基与氢氧化钠反应,所以等物质的量的①③分别消耗NaOH物质的量之比为1 ∶2,但没有①③的量,故错误。
考点:考查有机化学结构与性质的关系。
本题难度:困难
5、选择题 下列关于有机物的正确说法是
A.聚乙烯可发生加成反应
B.石油干馏可得到汽油、煤油等
C.乙酸乙酯、油脂与NaOH溶液反应均有醇生成。
D.淀粉、蛋白质完全水解的产物互为同分异构体
参考答案:C
本题解析:聚乙烯不再有碳碳双键,则不可发生加成反应,故A错误;
石油分馏可得到汽油、煤油等,故B错误;
乙酸乙酯在NaOH溶液中水解可生成乙醇,油脂在NaOH溶液中水解可生成丙三醇(甘油),故C正确;
淀粉完全水解的产物是葡萄糖,蛋白质完全水解的产物是氨基酸,两者分子式不同,则不互为同分异构体,故D错误;
本题难度:一般