时间:2017-08-08 05:07:48
1、选择题 在铝和NaOH溶液的反应中,作为氧化剂的是( )
A.水
B.铝
C.氢氧化钠
D.氢氧化钠和水
参考答案:A
本题解析:在铝和NaOH溶液的反应中,铝先和水反应,生成氢氧化铝和氢气,水做氧化剂,铝做还原剂,然后生成的氢氧化铝在和氢氧化钠反应生成偏铝酸钠和水,是非氧化还原反应,故铝和NaOH溶液反应氧化剂是水,选A 。
本题难度:一般
2、选择题 已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+)下列说法正确的是( )
A.铈溶于氢碘酸的化学方程式可表示为Ce+4HI=CeI4+2H2↑
B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈
D.四种铈的核素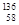 Ce、
Ce、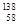 Ce、
Ce、 Ce、
Ce、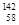 Ce,它们互称为同素异形体
Ce,它们互称为同素异形体
参考答案:C
本题解析:根据题中信息可知铈是一种很活泼的金属,且氧化性Ce4+>Fe3+,由于Fe3+能氧化I-,故Ce4+也能氧化I-,因此铈与氢碘酸反应不能生成Ce4+,A项错误;B项中所给方程式电荷不守恒;D项中四种核素互为同位素
本题难度:一般
3、填空题 (12分)人体内的铁不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给人补充所需铁元素时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可将食物中的Fe3+转变成Fe2+,有利于人体吸收。
(1)在人体中进行下列转化时 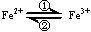 ,②中的Fe3+作 剂。
,②中的Fe3+作 剂。
(2)“服用维生素C,可将食物中的Fe3+转化成Fe2+ ”这句话指出,维生素C在这一反应中作 剂,
具有 性;某同学欲通过实验探究维生素C的这种性质,可选择的试剂是 (填字母)。
a.KI溶液 b.碘水、淀粉 c.酸性高锰酸钾溶液
参考答案:(1)氧化剂;(2) 还原(剂); 还原(性); C
本题解析:(1)铁元素的化合价降低,做氧化剂;(2)维生素是铁离子变成亚铁离子,使铁的化合价降低,所以维生素是还原剂,有还原性,还原性的物质能与具有氧化性的高锰酸钾反应,所以选C。
考点:维生素的性质,氧化还原反应。
本题难度:一般
4、选择题 某气态的烷烃与烯烃的混合气体9 g,其密度为同状况下H2密度的11.2倍,将混合气体通过足量的溴水,溴水增重4.2 g,则原混合气体的组成为( )
A.甲烷,乙烯
B.甲烷,丙烯
C.乙烷,乙烯
D.甲烷,丁烯
参考答案:B
本题解析:试题分析:混合气体的密度为同状况下H2密度的11.2倍,即混合气体的平均相对分子质量为22.4,溴水增重4.2 g,说明烯烃重为4.2g,烷烃为4.8g,对于B选项来说,甲烷的分子量为16,丙烯为42,即甲烷和丙烯分别为0.3mol和0.1mol,故其混合的分子量为(0.3 16+0.1
16+0.1 42)/(0.3+0.1)=22.4,所以答案为B,其他选项都不符合,所以答案为B。
42)/(0.3+0.1)=22.4,所以答案为B,其他选项都不符合,所以答案为B。
考点:有机物的计算
点评:本题考查了有机物的相关计算,该题比较麻烦,有一定的难度。
本题难度:一般
5、选择题 已知下列反应:Co2O3+6HCl(浓)=2CoCl2+Cl2↑+3H2O?(I)
5Cl2+I2+6H2O=10HCl+2HIO3?(II)
下列说法正确的是
A.反应I中HCl是氧化剂
B.反应II 中Cl2发生氧化反应
C.还原性:CoCl2>HCl>I2
D.氧化性:Co2O3>Cl2>HIO3
参考答案:D
本题解析:试题分析:抓住化合价的变化这一特征,分析Co2O3+6HCl(浓)=2CoCl2+Cl2↑+3H2O 中 Co2O3?中的Co为+3价, CoCl2中的Co为+2价 ,故Co2O3为氧化剂将HCl氧化为Cl2;故Co2O3的氧化性大于Cl2;在5Cl2+I2+6H2O=10HCl+2HIO3中Cl2将I2氧化为HIO3故Cl2的氧化性大于HIO3
考点:考查基本理论,氧化还原反应
本题难度:困难