时间:2017-08-08 04:55:11
1、选择题 关于元素周期表的下列叙述,错误的是
[? ]
A.元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一
B.在周期表中,把电子层数相同的元素排成一横行,称为一周期
C.元素周期表中,总共有18个纵行,18个族
D.第IA族的元素又称为碱金属元素(除了H),第VIIA族的元素又称为卤族元素
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列关于碳族元素的叙述,不正确的是( )
A.碳族元素位于元素周期表的ⅣA族,原子最外层有4个电子
B.随着核电荷数的递增,非金属性逐渐减弱、金属性逐渐增强
C.随着核电荷数的递增,单质的熔沸点逐渐升高
D.随着核电荷数的递增,最高价氧化物对应水化物的酸性逐渐增强
参考答案:A、碳族元素位于元素周期表中第 ⅣA族,同主族最外层电子式相同,原子最外层有4个电子,故A正确;
B、同主族元素,从上到下,随着核电荷数的递增,非金属性逐渐减弱、金属性逐渐增强,故B正确;
C、第ⅣA族元素的单质,有非金属单质,也有金属单质,所以单质的熔沸点不随核电荷数的递增而升高,故C错误;
D、同主族元素,从上到下,随着核电荷数的递增,非金属性逐渐减弱,对应最高价氧化物对应水化物的酸性逐渐减弱,故D错误;
故选CD.
本题解析:
本题难度:一般
3、填空题 (10分)我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下: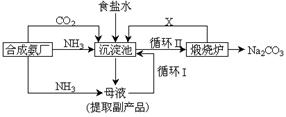
①上述生产纯碱的方法称?,
②沉淀池中发生的化学反应方程式是? ?。
③写出上述流程中X物质的分子式? ?。
④向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有?。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
参考答案:①联合制碱法或侯德榜制碱法
②NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓
③CO2
④A、C
本题解析:解:(1)目前工业制碱方法有二:氨碱法和联合制碱法.题中方法由我们侯德邦所创,称为侯氏制碱法,也称为联合制碱法,故答案为:联合制碱法或侯德榜制碱法
(2)反应方程式为NH3+H2O+CO2+NaCl→NH4Cl+NaHCO3↓,沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,反应方程式为NH3+H2O+CO2+NaCl→NH4Cl+NaHCO3↓,
故答案为:NH3+H2O+CO2+NaCl→NH4Cl+NaHCO3↓;
(3)在联合制碱法中二氧化碳是反应的原料同时也是反应的副产物,可以循环利用,
故答案为:CO2;?
(3)向母液中通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度.
(4)故答案为:ac.
点评:根据联合制碱法的原料为氨气、二氧化碳和饱和氯化钠,反应式为NH3+H2O+CO2+NaCl→NH4Cl+NaHCO3↓;
主要的副产物为氯化铵,需要考虑氯化铵的回收利用,要提高原料的利用率,可以用循环使用的方法,在等知识点来解题 ,难度不大。
本题难度:一般
4、填空题 X、Y、Z是主族的三种非金属元素,它们在周期表中的位置如下表所示
试回答:
(1)X元素单质的化学式是________________。
(2)Y元素的原子结构示意图是_______,Y与Na 所形成化合物的电子式为____________。
(3)Z元素的名称是________,从元素原子得失电子的角度看,Z元素具有_______性;若从Z元素在周期表中所处位置看,它具有这种性质的原因是__________。
参考答案:(1)F2
(2)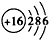 ;
;
(3)砷;两;Z位于元素周期表中金属与非金属交界线附近。
本题解析:
本题难度:一般
5、选择题 下表所列各组物质中,物质之间通过一步反应不能实现“ ”转化的是
”转化的是
| ?物质 选项 | 甲 | 乙 | 丙 |
| A | Si | SiO2 | H2SiO3 |
| B | NO | NO2 | HNO3 |
| C | Na | NaCl | NaOH |
| D | CH2=CH2 | CH3CH2OH | CH3CHO |
参考答案:A
本题解析:A、二氧化硅不溶于水不能直接生成硅酸,错误;B、正确;C、甲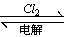 乙
乙 丙,正确;D、正确。
丙,正确;D、正确。
本题难度:一般