时间:2017-08-08 04:48:04
1、填空题 (15分)
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:?
(2)H3PO2及NaH2PO2)均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①(H3PO2)中,磷元素的化合价为?
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为:? (填化学式)
③NaH2PO2是正盐还是酸式盐??其溶液显?性(填弱酸性、中性、或者弱碱性)
(3)(H3PO2)的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2),后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式:?
(4)(H3PO2)也可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):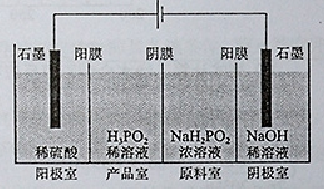
①写出阳极的电极反应式?
②分析产品室可得到H3PO2的原因 ?
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是?杂质。该杂质产生的原因是:?
参考答案:(1)H3PO2 H++H2PO2-;(2)①+1;②H3PO4;③正盐 弱碱性;
H++H2PO2-;(2)①+1;②H3PO4;③正盐 弱碱性;
(3)2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+3PH3↑;
(4) ① 2H2O-4e-=O2↑+4H+;②阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO3-穿过阴膜扩散至产品室,二者反应生成)③? PO43-;H3PO3或H2PO2-被氧化。
本题解析:(1)由于H3PO2是一种中元强酸,所以其电离方程式是H3PO2 H++H2PO2-;(2)①根据化合物中正负化合价的代数和为0,H是+1价,O是-2价。所以在H3PO2中P元素的化合价为+1价。②根据题意结合电子守恒、原子守恒可知:氧化产物为H3PO4,还原产物是Ag。③根据元素的化合价及电离情况可知H3PO2的结构是
H++H2PO2-;(2)①根据化合物中正负化合价的代数和为0,H是+1价,O是-2价。所以在H3PO2中P元素的化合价为+1价。②根据题意结合电子守恒、原子守恒可知:氧化产物为H3PO4,还原产物是Ag。③根据元素的化合价及电离情况可知H3PO2的结构是 ,所以NaH2PO2是正盐;由于该盐是强碱弱酸盐,所以该溶液显弱碱性。(3)根据题意可得白磷与氢氧化钡溶液反应的化学方程式是2P4+3Ba(OH)2+ 6H2O= 3Ba(H2PO2)2 +3PH3↑;(4)①在阳极由于含有的阴离子OH-、SO42-、H2PO2-中放电能力最强的是OH-,所以发生反应: 2H2O-4e-=O2↑+4H+;②在产品室只所以可得到H3PO2是因为阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO3-穿过阴膜扩散至产品室,二者反应生成)③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是阳极产生的氧气会把H3PO3或H2PO2-氧化为PO43-,是产品不纯。
,所以NaH2PO2是正盐;由于该盐是强碱弱酸盐,所以该溶液显弱碱性。(3)根据题意可得白磷与氢氧化钡溶液反应的化学方程式是2P4+3Ba(OH)2+ 6H2O= 3Ba(H2PO2)2 +3PH3↑;(4)①在阳极由于含有的阴离子OH-、SO42-、H2PO2-中放电能力最强的是OH-,所以发生反应: 2H2O-4e-=O2↑+4H+;②在产品室只所以可得到H3PO2是因为阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO3-穿过阴膜扩散至产品室,二者反应生成)③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是阳极产生的氧气会把H3PO3或H2PO2-氧化为PO43-,是产品不纯。
本题难度:一般
2、填空题 已知25℃时几种物质的电离度(溶液浓度均为0.1mol/L)?如下表(已知硫酸的第一步电离是完全的):
| ①硫酸溶液 | ②硫酸氢钠溶液 | ③醋酸溶液 | ④盐酸 HSO4-?H++SO42- HSO4-?H++SO42- CH3COOH?CH3COO-+H+ HCl=H++Cl- 10% 29% 1.33% 100% |
参考答案:(1)硫酸第一步电离出氢离子和硫酸氢根离子,硫酸氢根离子电离较弱,在硫酸溶液中主要以硫酸氢根离子存在,氢氧化钡溶于水电离出的氢氧根离子和氢离子反应促进硫酸氢根离子电离,同时硫酸根离子和钡离子反应生成硫酸钡沉淀,所以离子反应方程式为:H++HSO4-+Ba2++2OH-=BaSO4↓+2H2O,
故答案为:H++HSO4-+Ba2++2OH-=BaSO4+2H2O;
(2)硫酸第一步完全电离,第二步部分电离,硫酸中C(H+)=(0.1+0.1×10%)mol/L=0.11mol/L;
硫酸氢钠溶液中,C(H+)=(0.1×29%)mol/L=0.029mol/L;
醋酸溶液中,C(H+)=(0.1×1.33%)mol/L=0.00133mol/L;
盐酸溶液中,C(H+)=0.1mol/L;
所以C(H+)由大到小的顺序是①④②③,故答案为:①④②③;
(3)等体积pH=1的上述几种溶液中,氢元素的物质的量由大到小的顺序是③②①④,则生成氢气的体积③②①④,
故答案为:③②①④;
(4)硫酸溶液中,硫酸第一步电离出氢离子,第二步又电离出氢离子,第一步电离出的氢离子抑制了第二步的电离,而硫酸氢钠溶液中硫酸氢根离子只有一步电离,所以.1mol/L?H2SO4中的HSO4-的电离度小于0.1mol/L?NaHSO4中HSO4-的电离度,
故答案为:硫酸的第一步电离抑制了硫酸氢根离子的电离.
本题解析:
本题难度:一般
3、选择题 在CH3COOH?H++CH3COO-的电离平衡中,要使电离平衡向逆反应方向移动,不应采取的措施是( )
A.加H2SO4
B.加NaOH固体
C.加CH3COONa
D.加盐酸
参考答案:A.向醋酸中加入硫酸,溶液中氢离子浓度增大,抑制醋酸电离,平衡向逆反应方向移动,故A不选;
B.向溶液中加入固体氢氧化钠,氢氧根离子和氢离子反应生成水,所以能促进醋酸电离,平衡向正反应方向移动,故B选;
C.向醋酸中加入醋酸钠固体,醋酸钠中含有醋酸根离子,所以溶液中醋酸根离子浓度增大,抑制醋酸电离,平衡向逆反应方向移动,故C不选;
D.向溶液中加入盐酸,溶液中氢离子浓度增大,抑制醋酸电离,平衡向逆反应方向移动,故D不选;
故选B.
本题解析:
本题难度:一般
4、选择题 下列事实一定能说明HF是弱酸的是(?)
①常温下NaF溶液的pH大于7;?②用HF溶液做导电性实验,灯泡很暗;
③HF溶液与NaCl溶液不能发生反应;④常温下0.1mol/L的HF溶液的pH为2.3
A.①②③
B.①②④
C.①②③④
D.①④
参考答案:D
本题解析:常温下碱性溶液中PH>7,NaF溶液的pH大于7说明呈碱性,说明NaF发生了水解,HF是弱酸,故①正确;导电性强弱主要与离子浓度有关,不能说明HF是弱酸,故②错误;HF与NaCl不能发生反应与HF是弱酸无关,故③错误;常温下0.1mol/L的HF溶液的pH为2.3说明HF部分电离是弱酸,故④正确;所以本题选择D选项。
点评:本题考查弱电解质的判断,该考点是高考考查的重点和难点,掌握弱电解质是部分电离的解题的关键,本题难度适中。
本题难度:一般
5、选择题 在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是( )
A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
B.盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取
C.相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大
D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
参考答案:AC
本题解析:
本题难度:简单