时间:2017-08-08 04:40:33
1、选择题 下列化学工业中,未涉及原料循环使用的是
A.侯德榜制碱法
B.索尔维制碱法
C.工业电解饱和食盐水
D.工业炼铁
参考答案:D
本题解析:A.侯德榜制碱法可循环利用的物质有二氧化碳和氯化钠。B.索尔维制碱法物质有二氧化碳和氯化钠C.工业电解饱和食盐水后析出氢氧化钠后的氯化钠溶液仍可以循环利用。D.工业炼铁无法做到原料循环使用,选D。
本题难度:一般
2、选择题 “绿色商品”是指对环境无污染的商品,下列属于“绿色商品”的是
[? ]
A.含氟冰箱
B.含铅汽油
C.含磷洗衣粉
D.含碘食盐
参考答案:D
本题解析:
本题难度:简单
3、填空题 (15分)
纯碱一直以来都是工业生产的重要原料,很长一段时间来纯碱的制法都被欧美国家所垄断。上个世纪初我国著名的工业化学家侯德榜先生,经过数年的反复研究终于发明了优于欧美制碱技术的联合制碱法(又称侯氏制碱法)。并在天津建造了我国独立研发的第一家制碱厂。其制碱原理的流程如下:
⑴侯德榜选择天津作为制碱厂的厂址有何便利条件(举二例说明)?、?。
⑵合成氨工厂需要向制碱厂提供两种原料气体,它们分别是:?、?。(填化学式)这两种气体在使用过程中是否需要考虑添加的顺序:?(填“是”或“否”),原因是:?。
⑶在沉淀池中发生的反应的化学方程式是:?。
⑷使原料水中溶质的利用率从70%提高到90%以上,主要是设计了?(填上述流程中的编号)的循环。从母液中可以提取的副产品的应用是?(举一例)。
参考答案:
⑴原料丰富、运输便利?各1分(其它合理答案均可)
⑵CO2、NH3?各2分
是? 1分
氨气在水中溶解度大,先通氨气后通CO2产生碳酸氢铵多,有利于碳酸氢钠析出2分
⑶NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl?2分
⑷循环I? 2分
作化肥? 2分(其它合理答案均可)
本题解析:略
本题难度:一般
4、填空题 海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表的________族。
(2)目前,国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸气,蒸气经冷却而得高纯度的淡水。由此可判断蒸馏法是________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:
NaCl+H2O NaOH+H2↑+Cl2↑(未配平),该反应中NaCl的电子式是______;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
NaOH+H2↑+Cl2↑(未配平),该反应中NaCl的电子式是______;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下图: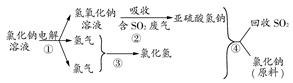
请写出②④的化学反应方程式:________、________。
参考答案:(1)ⅠA
(2)物理变化
(3) 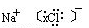 ?585
?585
(4)NaOH+SO2=NaHSO3? NaHSO3+HCl=NaCl+H2O+SO2↑
本题解析:(1)氯化钠中的金属元素为钠,它应位于元素周期表的ⅠA族。
(2)将海水蒸馏变成水蒸气属于物理变化。
(3)NaCl的电子式为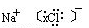 ,要制36.5%的浓盐酸1000 t所消耗的食盐应为
,要制36.5%的浓盐酸1000 t所消耗的食盐应为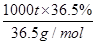 ×58.5 g/mol=585 t。
×58.5 g/mol=585 t。
(4)由图示给出的反应物和生成物不难写出②的反应方程式为NaOH+SO2=NaHSO3,④的反应方程式为NaHSO3+HCl=NaCl+H2O+SO2↑。
本题难度:一般
5、选择题 在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是?
[? ]
参考答案:B
本题解析:
本题难度:简单