时间:2017-08-08 04:34:08
1、填空题 (1)下图为CO2分子晶体结构的一部分。观察图形,试说明每个CO2分子周围有?个与之紧邻等距的CO2分子。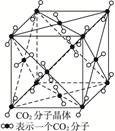 ?
?
(2)试判断:①CO2、②CS2、③SiO2晶体的沸点由高到低排列的顺序是?>?>?(填写相应物质的编号)。
2、选择题 根据价层电子对互斥模型,判断下列分子或者离子的空间构型不是三角锥形的( )
A.PCl3
B.H3O+
C.HCHO
D.PH3
3、填空题 (10分)中国古代四大发明之一——黑火药,它的爆炸反应为
①除S外,上列元素的电负性从大到小依次为?。
②在生成物中,A的晶体类型为??A的电子式为?
③。原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为?,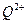 的未成对电子数是?。
的未成对电子数是?。
4、填空题 下表为长式周期表的一部分,其中的编号代表对应的元素。 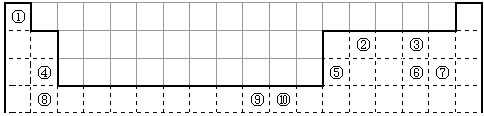
请回答下列问题
(1)表中属于d区的元素是________________(填编号)。
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为_________________(用对应的元素符号表示)。 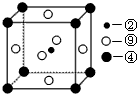
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是__________________。
A.分子中含有氢键
B.属于非极性分子
C.含有4个σ键和1个π键
D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为_________;该元素与元素①形成的分子X构形为______________;X在①与③形成的分子Y中的溶解度很大,其主要原因是__________________________。
(5)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:__________________ 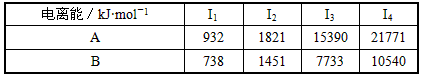
(6)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或
d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+
_____________颜色(填“无”或“有”)。
5、选择题 有关晶格能的叙述正确的是
A.晶格能是气态离子形成1摩离子晶体释放的能量
B.晶格能通常取正值,但是有时也取负值
C.晶格能越大,形成的离子晶体越不稳定
D.晶格能越大,物质的硬度反而越小