时间:2017-08-08 04:27:05
1、填空题 (16分)如图所示,通电5 min后,电极5的质量增加了2.16 g,回答:
(1)电源:a是________极,C池是________池。
A池阳极电极反应式为__________________,阴极电极反应式为__________________。
C池阳极电极反应式__________________,阴极电极反应式为_____________________。
(2)如果B槽中共收集到224 mL气体(标准状况),且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为______________________。
(3)如果A池溶液也是200 mL(电解过程中溶液体积不变),则通电后,溶液的pH为[________。
参考答案:(1)负 电解 2Cl--2e-===Cl2↑? 2H++2e-===H2↑
Cu-2e-===Cu2+? 2Ag++2e-===2Ag? (2)0.025 mol·L-1 (3)13
本题解析:(1)电极5的质量增加了2.16 g,说明电极5是阴极,则电极6是阳极,所以b是电源的负极,a是电源的负极。则电极1、3是阴极,电极2、4是阳极。A中阳极是氯离子放电,产生氯气。阴极是氢离子放电,产生氢气。C中阳极是铜,属于活性电极,铜失去电子。阴极是溶液中的银离子放电,析出银。
(2)B是电解硫酸铜,阳极是OH-放电产生氧气。阴极先是铜离子放电,析出铜,然后是氢离子放电产生氢气。电极5的质量增加了2.16 g,所以析出的银是0.02mol,转移电子是0.02mol。则B中生成氧气是0.005mol,体积是0.005mol×22.4L/mol=112ml,所以氢气也是112ml。根据电子守恒可知,铜离子得到的电子是0.02mol-0.005mol×2=0.01mol,因此铜离子的物质的量是0.005mol。则硫酸铜的浓度是0.005mol÷0.2L=0.025mol/L。
(3)根据反应式2NaCl+2H2O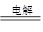 2NaOH+H2↑+Cl2↑可知,生成的氢氧化钠是0.02mol,其浓度是0.1mol/L,所以pH=13。
2NaOH+H2↑+Cl2↑可知,生成的氢氧化钠是0.02mol,其浓度是0.1mol/L,所以pH=13。
本题难度:一般
2、选择题 在一电解槽的中间加一镁片将其分成隔开的两部分,左侧加适量的NaOH溶液,并插入一根铝棒,右侧加适量的浓HCl,并插入一根铝棒。如图所示,下列有关说法中不正确的是(?) 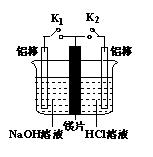
A.当闭合K1打开K2时,铝做负极
B.当闭合K2打开K1时,镁做负极
C.当K1、K2都闭合时,镁片上产生的气泡速度比只闭合一个电键时更快
D.当K1、K2都打开时,仍存在金属的腐蚀
参考答案:C
本题解析:略
本题难度:一般
3、选择题 用石墨作电极电解 溶液时,图12-5所示的电解变化曲线合理的是
溶液时,图12-5所示的电解变化曲线合理的是
A.①④
B.②④
C.②③
D.①③
参考答案:A
本题解析:电解开始一段时间:
阳极:2Cl-- 2e- = Cl2↑、阴极:2H20 +2e-= H2↑+ 2OH-
总反应:2AlCl3+6H20=2Al(OH)3↓+3H2↑+3Cl2↑
当AlCl3全部电解反应完之后,就等于再电解水:
阳极反应:4OH—-4e—=2H2O+O2↑
阴极反应:2H++2e—=H2↑
总反应:2H2O=(通电)2H2↑+O2↑
所以不会有多余的OH—,溶液PH不会大于7,Al(OH)3沉淀也不会溶解
故答案为A
本题难度:一般
4、选择题 下列设备工作过程中,将电能转化为化学能的是
参考答案:A
本题解析:充电是将电能转化为化学能,A对;太阳能交通灯是将太阳能转化为电能,电能再转化为光能,,B错;电饭煲煮饭是将电能转化为热能,C错;天然气汽车是将化学能转化为电能,D错。
考点:能量的转化形式。
本题难度:一般
5、选择题 镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应用。电解质溶液为KOH溶液,电池反应为:
Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是
Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是
[? ]
A.放电时电池内部OH-向正极移动
B.放电时正极附近溶液的pH减少
C.充电时阳极反应为 Cd(OH)2+2e-=Cd+2OH-
D.充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
参考答案:D
本题解析:
本题难度:一般