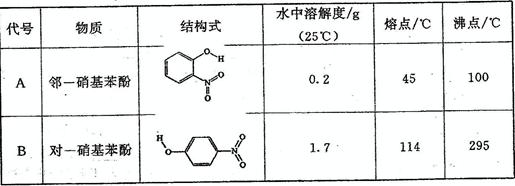
1、选择题 用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释不正确的是
[? ]
A.铝在空气中能很快形成氧化膜
B.铝箔表面温度低,未熔化
C.氧化铝的熔点比铝高
D.氧化铝薄膜包住了熔化的铝
2、填空题 某研究小组将一批废弃的线路板经浓硝酸和稀硫酸处理后得到一混合溶液,其中含有Cu2+、Fe2+、Fe3+、Al3+等金属离子,并设计了以下两种流程以分别制取CuSO4·5H2O晶体和AlCl3
溶液:

已知:相关金属离子开始沉淀至完全沉淀时的pH范围为:
离子
| Fe3+
| Fe2+
| Al3+
| Cu2+
|
pH范围
| 2.2~3.2
| 5.5~9.0
| 4.1~5.0
| 5.3~6.6
|
请回答下列问题:
(1)加入H2O2的作用是
?,欲使制取的CuSO4·5H2O晶体较为纯净,pH至少应调至
。
(2)写出H2O2与Fe2+反应的离子方程式:
?。
(3)流程②中加入适量Al粉起的作用是
? 。
(4)根据你所学的化学知识,由AlCl3溶液(不添加其他化学试剂)能否制得无水AlCl3
(填“能”或“不能”),原因是
?。
(5)取体积为V(L)的酸浸液,向其中滴加a mol·L-1的NaOH溶液,生成沉淀的物质的量与所加的NaOH溶液的体积(L)关系如图。请用V1、V2、V3表示所取的酸浸液中n(Fe3+)∶n(Al3+)=
?。

3、选择题 Fe2O3和Al2O3都
A.是两性氧化物
B.可与氢氧化钠溶液反应
C.可与盐酸反应
D.可溶于水
4、选择题 当光束通过下列分散系时,能观察到丁达尔效应的是
A.蔗糖溶液
B.盐酸
C.氯化钠溶液
D.Fe(OH)3胶体
5、填空题 A.《物质结构与性质》
(1)前三周期元素中第一电离能最小的是? _______?(填元素符号),其基态原子的电子排布式为? _______?。第二周期非金属元素形成的氢化物中化学键极性最大的是? _______?
(填分子式),该物质在CCl4中的溶解度比在水中的溶解度? _______?(填“大”或“小”)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是
? _______?(填物质字母代号)。
(3)晶格能的大小:MgO
? _______?NaCl,键能的大小:HBr
? _______?HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是
? _______? A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
B《实验化学》
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1?部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Mn(OH)2
| Mg(OH)2
|
pH值
| 5.2
| 3.2
| 9.7
| 10.4
| 11.2
|
表2?两种盐的溶解度(单位为g/100g水)
温度 / ℃
| 10
| 30
| 40
| 50
| 60
|
CaSO4
| 0.19
| 0.21
| 0.21
| 0.20
| 0.19
|
MgSO4·7H2O
| 30.9
| 35.5
| 40.8
| 45.6
| /
|
硼镁泥制取七水硫酸镁的工艺流程如下:
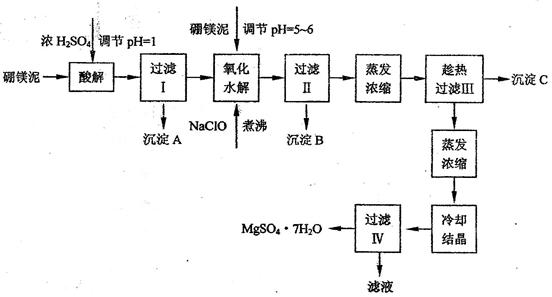
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为
? _______?。加热煮沸的主要目的是_
? _______?。
(2)沉淀B中除MnO2、SiO2外还含有
? _______?(填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是
? _______?;
(4)沉淀C的化学式是
? _______?。过滤II需趁热过滤的理由是
? _______?