时间:2017-08-08 04:16:35
1、选择题 已知100℃时,0.01mol·L-1 NaHSO4溶液中水电离的c(H+)=10-10 mol·L-1,该温度下将pH=8的Ba(OH)2溶液V1 L与pH=5 V2 L NaHSO4混合,所得溶液pH=7,则 V1∶V2=
A.2∶9
B.1∶9
C.1∶1
D.1∶2
参考答案:A
本题解析:0.01mol·L-1 NaHSO4溶液中水电离的c(H+)=10-10 mol·L-1,说明溶液中OH-的浓度也是10-10 mol·L-1,氢离子浓度是0.01mol/L,所以该温度下水的离子积常数为1×10-12。所得溶液pH=7,说明溶液显碱性,即碱是过量的,所以有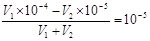 ,解得V1∶V2=2∶9,答案选A。
,解得V1∶V2=2∶9,答案选A。
本题难度:简单
2、选择题 下列各溶液中,微粒的物质的量浓度关系表述正确的是
A.常温下pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7
B.0.lmol/LNa2CO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.0.2mol/LNaA溶液和0.lmol/L盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A—)+c(Cl—)
D.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等
参考答案:A
本题解析:试题分析:A、混合后醋酸过量,溶液呈酸性,正确;B、物料守恒为c(Na+)=2[c(HCO3-)+c(H2CO3)+ c(CO32-)],错误;C、混合后为NaHA溶液,呈碱性,说明水解大于电离,电荷守恒为c(Na+)+c(H+)=c(A—)+c(Cl—)+c(HA-),错误;D、前者为抑制水的电离,后者促进水的电离,故电离的不等,错误。
考点:考查电解质溶液,涉及弱电解的电离、盐类水解、水的电离及三大守恒的应用。
本题难度:简单
3、选择题 切取一小块钠放在玻璃片上至足够长的时间,整个过程观察到的现象描述正确的是.
A.银白色→灰白色→液滴→白色晶体→白色粉末
B.银白色→暗白色→液滴→白色晶体→白色粉末
C.银白色→暗白色→白色晶体→白色粉末
D.银白色→灰白色→白色晶体→白色粉末
参考答案:B
本题解析:钠氧化成Na2O而变暗,Na2O又变为NaOH而潮解.NaOH溶液又变为Na2CO3·10H2O白色晶体,最后风化成无水Na2CO3白色粉末.
本题难度:一般
4、选择题 二氧化碳通入下列溶液中,不可能产生沉淀的是
A.氯化钙溶液
B.石灰水
C.饱和碳酸钠溶液
D.硅酸钠溶液
参考答案:A
本题解析:此类题主要从反应条件、原理去分析反应①是在水溶液中进行的复分解反应,反应②是固体与固体之间的反应(非水条件);①是常温下的反应,②是高温条件下的反应.两个反应的条件不同,实质上没有可比性,因为它们的反应原理、反应条件与本质均不同.
本题难度:简单
5、选择题 将13.4g KCl和KBr的混合物,溶于水配成溶液,通入过量的Cl2充分反应后,蒸干溶液并灼烧,得到固体物质11.75g,则配制的溶液中K+、Cl-、Br-的个数比为
A.1∶2∶3
B.1∶3∶2
C.2∶3∶1
D.3∶2∶1
参考答案:D
本题解析:此题作为选择题,可根据离子电荷守恒来巧解,即K+的个数一定等于C-与Br-的个数之和,根据离子个数比,只有3∶2∶1符合实际.
本题难度:一般