时间:2017-08-08 04:11:05
1、填空题 通常人们把拆开1mol?某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。?
化学键?Si—O?Si—Cl?H—H?H—Cl?Si—Si?Si—C?
键能/?kJ?mol—1?460?360?436?431?176?347?
请回答下列问题:?
⑴?比较下列两组物质的熔点高低(填>或<)?
SiC______?Si;?SiCl4?______?SiO2?
⑵?图立方体中心的“●”表示硅晶体中的一个原子,?请在立方体的顶点用“●”表示出与之紧邻的硅原子。?
⑶?工业上高纯硅可通过下列反应制取:?SiCl4?(g)?+?2H2(g)?Si(s)?+?4HCl(g);该反应的反应热△H?=?___________?KJ/mol
参考答案:(1)>?<?
(2)如下图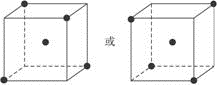
本题解析:本题主要考查键能的大小与物质性质及反应热之间的关系。
(1)SiC与Si皆为原子晶体,由于Si—C的键能大于Si—Si的键能,故SiC的熔点比Si高;SiCl4为分子晶体,SiO2为原子晶体,前者的熔点低于后者。
(2)根据硅原子与硅原子可形成4个相等的硅硅键可知除立方体中心的硅原子处,与它相邻的硅原子应处于可形成正四面体的4个顶点上。
本题难度:一般
2、选择题 下列每组物质中含有的化学键类型相同的是( )
A.NaCl、HCl、H2O、NaOH
B.Cl2、Na2S、HCl、SO2
C.HBr、CO2、H2O、CS2
D.Na2O2、H2O2、H2O、O3
参考答案:A、NaCl中含有离子键、HCl含有共价键、H2O含有共价键、NaOH含有离子键和共价键,故A不符合;
B、Cl2含有共价键、Na2S含有离子键、HCl含有共价键、SO2含有共价键,故B不符合;
C、HBr、CO2、H2O、CS2分子中含的化学键都是共价键,故C符合;
D、Na2O2含有离子键和共价键、H2O2含有共价键、H2O含有共价键、O3含有共价键,故D不符合;
故选C.
本题解析:
本题难度:简单
3、选择题 下列各组物质,化学键类型相同、晶体类型相同且熔化时破坏作用力类型也相同的是(?)
A.NaOH Na2O2
B.H2S CCl4
C.NH4Cl KCl
D.CO2 SiO2
参考答案:B
本题解析:B中,H2S、CCl4的化学键类型都为共价键,晶体类型类型都为分子晶体,熔化时破坏作用力类型属于分子间作用力,所以答案为B。
点评:本题考查对常见物质化学键类型、晶体类型的判断,是高考常考的考点,本题考查的都是常见的知识点,比较容易。
本题难度:一般
4、选择题 已知化学反应C(s)+O2(g) = CO2(g) 是放热反应。据此推断下列说法正确的是
A.反应物的总能量大于生成物的总能量
B.反应物的总能量小于生成物的总能量
C.反应物的总能量等于生成物的总能量
D.无法确定反应物总能量和生成物总能量的相对大小
参考答案:A
本题解析:考查放热反应和吸热反应的概念。如果反应物的总能量高于生成物的总能量,则反应是放热反应,反之是吸热反应。所以答案是A。
本题难度:简单
5、选择题 下列事实中,能够证明HCl是共价化合物的是
A.HCl易溶于水
B.液态的HCl不导电
C.HCl不易分解
D.HCl溶于水能电离,呈酸性
参考答案:B
本题解析:共价化合物的构成微粒不带电,则液态不导电。但离子化合物的构成微粒带电,其液态能导电,以此来证明氯化氢是共价化合物。
A、不能利用溶解性判断是否为共价化合物,如NaCl也易溶于水,但属于离子化合物,故A错误;
B、因共价化合物的构成微粒不带电,离子化合物的构成微粒带电,则可利用液态氯化氢不导电来证明氯化氢是共价化合物,故B正确;
C、不能利用分解来判断是否为共价化合物,如NaCl受热也不易分解,但属于离子化合物,故C错误;
D、氯化氢溶于水,溶液显酸性,不能作为判断是否为共价化合物的依据,例如硫酸氢钠溶于水也显酸性,而硫酸氢钠是离子化合物,故D错误,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。侧重对学生能力的培养和解题方法的指导与训练。有利于培养学生的逻辑思维能力和逆向思维能力。明确共价化合物的构成微粒是解答本题的关键。
本题难度:简单