时间:2017-08-08 03:58:17
1、选择题 下列叙述中错误的是
[? ]
A.钠原子和氯原子作用生成NaCl后,其结构的稳定性增强
B.在氯化钠中,除氯离子和钠离子的静电吸引力作用外,还存在电子与电子、原子核与原子核之间的排斥作用
C.任何离子键在形成的过程中必定有电子的得与失
D.钠与氯气反应生成氯化钠后,体系能量降低
参考答案:C
本题解析:
本题难度:简单
2、选择题 某短周期元素最外层只有2个电子,则该元素一定是( )
A.第1、2或3周期元素
B.最高正化合价为+2
C.IIA族元素
D.金属元素
参考答案:短周期元素最外层只有2个电子,则该元素可能为He元素或ⅡA族元素,则:
A、该元素可能是He元素、Be元素或Mg元素,故可以是第1、2或3周期元素,故A正确;
B、若该元素为He,主要化合价为0价,故B错误;
C、若该元素为He,为零族元素,故C错误;
D、若该元素为He,不是金属元素,故D错误;
故选A.
本题解析:
本题难度:一般
3、选择题 某元素原子核外L层电子数比K层电子数多3,则此元素在周期表中位于( )
A.第二周期第ⅤA族
B.第二周期第ⅦA族
C.第三周期第ⅤA族
D.第三周期第ⅦA族
参考答案:某元素原子核外L层电子数比K层电子数多3,K层电子数是2,L层电子数比K层电子数多3,则L层电子数是5,则该元素是N元素,该元素核外有2个电子层,所以在第二周期,其最外层电子数是5,则为第VA族,所以该元素位于第二周期第VA族,故选A.
本题解析:
本题难度:简单
4、选择题 化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A.CO2的电子式: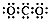
B.质量数为37的氯原子: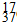
Cl
C.NH4Cl的电子式: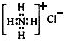
D.原子核内有10个中子的氧原子: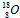
参考答案:D
本题解析:
本题难度:简单
5、填空题 下表为周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。?
(2)元素⑥形成的最高价含氧酸根的立体构型是 ,其中心原子的杂化轨道类型是 。
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键
B.属于非极性分子
C.含有4个σ键和1个π键
D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnn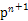 ,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是?。
,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是?。
(5)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。?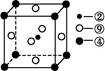
参考答案:(1)⑨ (2)正四面体形 sp3 (3)BD
(4)3 三角锥形 在NH3分子和水分子间有氢键作用
(5)MgNi3C
本题解析:(1)根据元素周期表结构可回答。(2)⑥对应的含氧酸根是S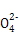 ,根据电子互斥理论,可判断S
,根据电子互斥理论,可判断S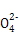 为正四面体结构,中心原子采用sp3杂化。(3)元素②为碳元素,根据该元素的氢化物地位和用途可判断该氢化物为CH2
为正四面体结构,中心原子采用sp3杂化。(3)元素②为碳元素,根据该元素的氢化物地位和用途可判断该氢化物为CH2 CH2(乙烯),该分子中C—H键为σ键,C
CH2(乙烯),该分子中C—H键为σ键,C C双键中有一个σ键和一个π键,其中C原子采用sp2杂化。该分子高度对称,属于非极性分子。选项BD正确。(4)nsnn
C双键中有一个σ键和一个π键,其中C原子采用sp2杂化。该分子高度对称,属于非极性分子。选项BD正确。(4)nsnn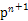 为p区元素,原子排布到p轨道时,s轨道应填充2个电子,故n=2,该元素的最外层电子排布为2s22p3。该元素为N元素,其中2s轨道中的电子为孤电子对。①为H元素,N与H形成NH3,由于N原子存在孤电子对,故NH3分子为三角锥形。①和③形成的化合物为H2O,NH3和H2O之间可形成氢键,故NH3易溶于水。(5)②、④、⑨对应的元素为C、Mg和Ni元素。C原子处于体心,即平均每个晶胞含有1个碳原子;Mg原子处于顶点,平均Mg原子个数为8×1/8=1;Ni原子位于面心,Ni原子个数为6×1/2=3,该化合物化学式为MgNi3C。
为p区元素,原子排布到p轨道时,s轨道应填充2个电子,故n=2,该元素的最外层电子排布为2s22p3。该元素为N元素,其中2s轨道中的电子为孤电子对。①为H元素,N与H形成NH3,由于N原子存在孤电子对,故NH3分子为三角锥形。①和③形成的化合物为H2O,NH3和H2O之间可形成氢键,故NH3易溶于水。(5)②、④、⑨对应的元素为C、Mg和Ni元素。C原子处于体心,即平均每个晶胞含有1个碳原子;Mg原子处于顶点,平均Mg原子个数为8×1/8=1;Ni原子位于面心,Ni原子个数为6×1/2=3,该化合物化学式为MgNi3C。
本题难度:一般