时间:2017-08-08 03:51:20
1、填空题 (10分)将含镁、钾的盐湖水蒸发,最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O)。
它在空气中极易潮解,易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定。
①准确称取5.550 g样品溶于水,配成100 mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580 g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305 g。
(1)步骤②中检验白色固体已洗净的方法是 。
(2)已知某温度下Mg(OH)2的Ksp = 6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol·L-1可视为沉淀完全,则应保持溶液的OH-的浓度≥ mol·L-1。
(3)通过计算确定样品的组成(写出计算过程)。
参考答案:(1)取最后一次洗涤液少许,滴加硝酸酸化的硝酸银溶液,若不产生沉淀,则已经洗涤干净;
(2)8.0×10-4;
(3)5.550g样品中含有n(Mg2+)=n(Mg(OH)2)="(0.580g÷58" g/mol)×2=0.0200mol;
n(MgCl2)= 0.0200mol;n(Cl-)=" n(AgCl)=(4.305g÷143." 5g/mol)×2=0.0600mol;
n(KCl)=0.0600mol-2×0.0200mol=0.0200mol;
n(H2O)= (5.550g-0.0200mol×95g/mol-0.0200mol×74.5g/mol)÷18g/mol=0.120mol.
样品中n(KCl):n(MgCl2):n(H2O)=1:1: 6。所以光卤石的化学式是KCl·MgCl2·6H2O.
本题解析:(1)将向含光卤石(xKCl·yMgCl2·zH2O)的水溶液中加入过量的NaOH溶液,会发生离子反应:Mg2++2OH-=Mg(OH)2↓,而K+、Na+、Cl-则留在滤液中。在步骤②中若要检验白色固体已洗净,只要证明在滤液中无Cl-即可,方法是取最后一次洗涤液少许,滴加硝酸酸化的硝酸银溶液,若不产生沉淀,则已经洗涤干净;
(2)在某温度下Mg(OH)2的Ksp = 6.4×10-12,即c(Mg2+)·c2(OH-)≥6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol·L-1 可视为沉淀完全,则应保持溶液的OH-的浓度c2(OH-)≥6.4×10-12÷1.0×10-5 mol·L=6.4×10-7mol/L; c(OH-)≥8×10-4mol/L;
(3) 5.550g样品中含有n(Mg2+)=n(Mg(OH)2)="(0.580g÷58" g/mol)×2=0.0200mol;
n(MgCl2)= 0.0200mol;n(Cl-)=" n(AgCl)=(4.305g÷143." 5g/mol)×2=0.0600mol;
n(KCl)=0.0600mol-2×0.0200mol=0.0200mol;
n(H2O)= (5.550g-0.0200mol×95g/mol-0.0200mol×74.5g/mol)÷18g/mol=0.120mol.
样品中n(KCl):n(MgCl2):n(H2O)=1:1: 6。所以光卤石的化学式是KCl·MgCl2·6H2O.
考点:考查沉淀的洗涤、溶度积常数的应用、守恒等知识。
本题难度:困难
2、填空题 FeS饱和溶液中存在溶解平衡:FeS(s) Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
⑴理论上FeS的溶解度为?。
⑵又知FeS饱和溶液中[H+]与[ S2-]之间存在着如下关系:[H+]2·[ S2-]=1.0×10-22 mol3/L3,为了使溶液里[Fe2+]达到了1mol/L,现将FeS适量投入到其饱和溶液中,应调节溶液中的[H+]为?。
参考答案:⑴7.92×10-8 g;⑵1.11×10-3mol/L。
本题解析:⑴由FeS(s) Fe2+(aq)+S2-(aq),[Fe2+]=
Fe2+(aq)+S2-(aq),[Fe2+]= =
= =9×
=9× mol/L,即水中溶解的FeS的溶解度为S(FeS)=9×
mol/L,即水中溶解的FeS的溶解度为S(FeS)=9× mol/L×88g/mol×
mol/L×88g/mol× =7.92×10-8 g;⑵由[Fe2+]=1mol/L,则[ S2-]=
=7.92×10-8 g;⑵由[Fe2+]=1mol/L,则[ S2-]= =
= =8.1×10-17 mol/L,又由于[H+]2·[ S2-]=1.0×10-22 mol3/L3,所以[H+]=1.11×10-3mol/L。
=8.1×10-17 mol/L,又由于[H+]2·[ S2-]=1.0×10-22 mol3/L3,所以[H+]=1.11×10-3mol/L。
本题难度:一般
3、选择题 硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥等.某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
A.向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小
B.图中a点对应的是饱和溶液
C.向c点的溶液中加入0.1mol?L-1Hg(NO3)2,则c(S2-)减小
D.升高温度可以实现c点到b点的转化
参考答案:A.溶液的温度不变,则Ksp不变,故A错误;
B.a点为不饱和溶液,故B错误;
C.温度一定,则难溶物质的溶度积一定,根据C(S2-)=KspC(Hg2+)知,汞离子浓度增大,则硫离子浓度减小,故C正确;
D.升高温度,促进硫化汞的电离,所以汞离子和硫离子浓度都增大,故D错误;
故选C.
本题解析:
本题难度:简单
4、填空题 以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。 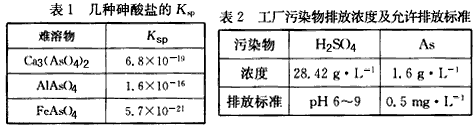
回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=________mol/L。
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=_________,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4 mol/L,c(ASO43-)最大为___________mol/L
(3)工厂排放出的酸性废水中的三价砷(H3ASO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷
(H3AsO4弱酸),写出该反应的离子方程式:__________________。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为_______________。
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为___________。
参考答案:(1)0. 29
(2)c3(Ca2+)·c2(AsO43-);5.7×10-17
(3)2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O
(4)①CaSO4;②H3AsO4是弱酸,当溶液中pH调节到8左右时AsO42-浓度增大,Ca3(AsO4)2开始沉淀
本题解析:
本题难度:一般
5、选择题 下列有关Ksp说法正确的是
A.某温度下, CaSO4溶液中C(Ca2+) ·C(SO42-)就是 Ksp
B.25 ℃时, Fe(OH)3固体在0.01mol/LNH4Cl溶液中的溶解度增大,其Ksp也增大。
C.在一定条件下实现BaSO4+Na2CO3 BaCO3+ Na2SO4,说明KSP(BaSO4)>KSP(BaCO3)
BaCO3+ Na2SO4,说明KSP(BaSO4)>KSP(BaCO3)
D.升高温度,若某沉淀溶解平衡逆向移动, Ksp也变小
参考答案:D
本题解析:
正确答案:D
A.不正确,应是:某温度下,饱和 CaSO4溶液中C(Ca2+) ·C(SO42-)就是 Ksp
B. 不正确,应是:25 ℃时, Fe(OH)3固体在0.01mol/LNH4Cl溶液中的溶解度增大,其Ksp不变,Ksp只与温度有关。
C. 不正确,应是:在一定条件下实现BaSO4+Na2CO3 BaCO3+ Na2SO4,说明溶解平衡是可逆的,KSP(BaSO4)<KSP(BaCO3)是物质固有性质
BaCO3+ Na2SO4,说明溶解平衡是可逆的,KSP(BaSO4)<KSP(BaCO3)是物质固有性质
D.升高温度,若某沉淀溶解平衡逆向移动,正向吸热, Ksp也变小,正确
本题难度:一般