时间:2017-08-08 03:45:27
1、选择题 下列方程式中是某种盐的水解方程式的是( )
A.HCO3-+H2O?CO32-+H3O+
B.Zn-2e-=Zn2+
C.NaHSO4=Na++H++SO42-
D.AlO2-+2H2O?Al(OH)3+OH-
参考答案:D
本题解析:
本题难度:简单
2、填空题 (10分)泡沫灭火器的工作原理就是我们学习的盐类水解,它是彻底的双水解,
(1)灭火器有两个桶构成,一个是外面的钢桶,用来盛装 (硫酸铝、碳酸氢钠填药品的化学式)一个是里面看不到的塑料桶,用来盛装 。(同上)
(2)用离子方程式表示塑料桶盛放该试剂的原因 。
(3)用离子方程式表示其工作原理 。
(4)用碳酸氢钠而不用碳酸钠做灭火器的药品其原因是 。
(5)碳酸氢钠溶液中质子守恒的表达式是 。
参考答案:24、(1)NaHCO3与Al2(SO4)3 (2) Al3++3 H2O
本题解析:
本题难度:困难
3、填空题 (10分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;
(2)氯化铝水溶液呈 性,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表
示): ;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用:
请回答下列问题:
①在上图的括号内应填的是在_______________环境中加热。
②Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固)  Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
③已知AnBm的离子积=c (Am+) n ·c (Bn-) m,式中c (Am+) n和c (Bn-) m表示离子的物质的量浓度,在室温时若测得Mg(OH)2饱和溶液的pH值为11,其离子积为___________________。
参考答案:(1)酸, Ag++ H2O 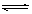 AgOH + H+
AgOH + H+
(2)酸, Al3++3H2O 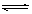 Al(OH)3+3H+, Al2O3 ;
Al(OH)3+3H+, Al2O3 ;
(3) ①HCl气流 ②酸、水、酸性气体、饱和NH4Cl等(任选两种)(每空1分)
③5×10-10(2分)
本题解析:(1)AgNO3是强酸弱碱盐,水解显酸性。
(2)氯化铝也是强酸弱碱盐,水解显酸性。铝离子水解生成氢氧化铝和氯化氢,水解吸热,加热促进水解。同时氯化氢的挥发,进一步促进水解,所以最终得到的是氢氧化铝,灼烧得到氧化铝。
(3)氯化镁水解显酸性,所以要得到氯化镁晶体,在加热时需要防止水解,因此在硫化氢的气流中加热即可。根据氢氧化镁的溶解平衡可知,要促进溶解,就必须使平衡向正反应方向移动。所以可以通过消耗OH-或镁离子来实现。根据离子积常数的概念可知,离子积常数是电离出的离子的浓度的幂之积,Mg(OH)2饱和溶液的pH值为11,则OH-的浓度为10-3mol/L,则镁离子浓度为5×10-4mol/L,所以氢氧化镁的离子积常数为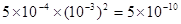 。
。
本题难度:困难
4、选择题 物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是( )
A.Na2CO3、NaHCO3、NaCl、NH4Cl
B.NH4Cl、NaCl 、Na2CO3、NaHCO3
C.(NH4)2SO4、NH4Cl、NaNO3、Na2S
D.NH4Cl 、(NH4)2SO4、Na2S 、NaNO3
参考答案:C
本题解析: NH4Cl强酸弱碱盐水溶液显酸性,NaCl是强酸强碱盐,溶液显中性; Na2CO3和NaHCO3都是强碱弱酸盐,水解使溶液显碱性,碱性Na2CO3>NaHCO3。所以按pH由小到大顺序排列是NH4Cl>NaCl> NaHCO3> Na2CO3。因此A、B都错误。NH4Cl是强酸弱碱盐水溶液显酸性,(NH4)2SO4是强酸弱碱盐水溶液显酸性,由于盐溶液物质的量浓度相同,铵根离子的浓度:(NH4)2SO4>NH4Cl。铵根离子的浓度越大,水解得到的c(H+)就越大,溶液的酸性就越强。所以pH大小关系是(NH4)2SO4<NH4Cl。NaNO3是强酸强碱盐,溶液显中性。Na2S是强碱弱酸盐,水解使溶液显碱性。所以pH由小到大顺序排列的是(NH4)2SO4<NH4Cl< NaNO3<Na2S。因此C正确,D错误。
考点:考查盐水解在比较盐溶液的pH的大小应用的知识。
本题难度:一般
5、选择题 下列溶液中有关物质的量浓度关系和计算不正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl)
B.已知25°C时 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 mol·L-1
mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有C(HA-) >C(H+)>C(A2-)>C(H2A)
参考答案:C
本题解析:C错;设溶液的体积各为1L;即0.2mol·L-1 HCl溶液中 ;0.05 mol·L-1 Ba(OH)2溶液中
;0.05 mol·L-1 Ba(OH)2溶液中 ;混合后,溶液中
;混合后,溶液中 ,混合后溶液中
,混合后溶液中 ,此时溶液的pH=1.3
,此时溶液的pH=1.3
本题难度:困难