时间:2017-08-08 03:45:27
1、填空题 计算多元弱酸(HnX)溶液的c(H+)及比较弱酸的相对强弱时,通常只考虑第一步电离。回答下列关于多元弱酸HnX的问题。
(1)若要使HnX溶液中c(H+)/c(HnX)增大,可以采取的措施是 。
A.升高温度 B.加少量固态HnX C.加少量NaOH溶液 D.加水
(2)用离子方程式解释NanX呈碱性的原因: 。
(3)若HnX为H2C2O4,且某温度下,H2C2O4的K1=5×10-2、K2=5×10-5.则该温度下,0.2mol/L H2C2O4溶液 中c(H+)约为 mol/L。(已知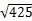
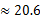 )
)
(4)已知KHC2O4溶液呈酸性。
①KHC2O4溶液中,各离子浓度由大到小的顺序是 。
②在KHC2O4溶液中,各粒子浓度关系正确的是 。
A.c(C2O42-)<c(H2C2O4)
B.c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
D.c(K+)= c(C2O42-)+ c(HC2O4-)+ c(H2C2O4)
参考答案:(1)AD (2)Xn- + H2O 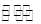 HX(n-1)- + OH- (3)0.078 (4)?
HX(n-1)- + OH- (3)0.078 (4)?
c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) ?CD
本题解析:
试题解析:(1)弱电解质的电离为吸热过程,升温促进电离,则比值增大,故A正确;加少量固态HnX,HnX浓度增大,弱电解质的浓度越大,电离程度越小,则比值减小,故B错误;加入NaOH溶液,消耗氢离子,使c(H+)减小,则比值减小,故C错误;加水,溶液体积增大,导致氢离子、醋酸浓度都减小,但是电离平衡向正向移动,氢 离子浓度减的少,HnX浓度减得大,比值增大,故D正确。(2)HnX是弱酸,Xn-在水溶液中存在水解平衡:Xn- + H2O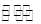 HX(n-1)- + OH-,故NanX溶液呈碱性;(3)K1=
HX(n-1)- + OH-,故NanX溶液呈碱性;(3)K1=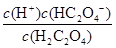 =5×10-2、K2=
=5×10-2、K2=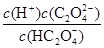 =5×10-5,解得,c(H+)=0.078mol/L;(4)?KHC2O4溶液呈酸性,说明草酸氢根离子的电离程度大于其水解程度,所以溶液显酸性,c(H+)>c(OH-) 溶液中离子浓度大小为:c(K+)>c( HC2O4-)>c(H+)>c(C2O42-)>c(OH-);? HC2O4-电离程度大于水解程度,c(C2O42-)>c(H2C2O4),故A错误;在KHC2O4溶液中,电荷守恒关系式为c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),物料守恒关系式为c(K+)= c(C2O42-)+ c(HC2O4-)+ c(H2C2O4),故C、D正确;由电荷守恒关系式和物料守恒关系式c(C2O42-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),故B错误。
=5×10-5,解得,c(H+)=0.078mol/L;(4)?KHC2O4溶液呈酸性,说明草酸氢根离子的电离程度大于其水解程度,所以溶液显酸性,c(H+)>c(OH-) 溶液中离子浓度大小为:c(K+)>c( HC2O4-)>c(H+)>c(C2O42-)>c(OH-);? HC2O4-电离程度大于水解程度,c(C2O42-)>c(H2C2O4),故A错误;在KHC2O4溶液中,电荷守恒关系式为c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),物料守恒关系式为c(K+)= c(C2O42-)+ c(HC2O4-)+ c(H2C2O4),故C、D正确;由电荷守恒关系式和物料守恒关系式c(C2O42-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),故B错误。
考点:弱电解质的电离
本题难度:一般
2、选择题 某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
A.该溶液可能由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量NaOH,溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
参考答案:A
本题解析:A、醋酸过量,溶液显酸性,只有Na+、CH3COO-、H+、OH-四种离子,正确;B、溶液NaOH与CH3COOH恰好完全反应,所以溶液呈碱性,错误;C、当加入NaOH后溶液仍然呈酸性,则c(H+)>c(OH-),不成立,当恰好完全反应,溶液呈碱性,则c(Na+)>C(CH3COO-),当碱过量时,必定c(Na+)>C(CH3COO-),所以在任何情况下溶液的离子关系都不能成立,错误;D、加入氨水,由电荷守恒得:c(CH3COO-)+c(OH-)=c(Na+)+c(NH4+)+c(H+),当溶液仍呈酸性即c(OH-)<c(H+),则c(CH3COO-)>c(NH4+)+c(Na+);当溶液呈中性时,c(H+)=c(OH-),则c(CH3COO-)=c(NH4+)+c(Na+);当溶液呈碱性时,c(H+)<c(OH-),则c(CH3COO-)<c(NH4+)+c(Na+),所以c(CH3COO-)不一定大于c(Na+)、c(NH4+)之和。
考点:考查溶液中的离子及其浓度比较。
本题难度:一般
3、选择题 常温下PH=2的A酸溶液和PH=12的B碱溶液等体积混合后,溶液的PH一定小于7,则A、B可能为
A.强酸、强碱
B.弱酸、弱碱
C.强酸、弱碱
D.弱酸、强碱
参考答案:D
本题解析:若为强酸、强碱,则混合后溶液的PH应=7;
要求混合后溶液的PH小于7,则余酸,所以:A、B可能为弱酸、强碱
本题难度:简单
4、填空题 明矾能净水是因为①Al3+能水解,②水解产物氢氧化铝具有____________能力。设计一个简单实验验证明矾溶于水发生了水解 。
参考答案:27.吸附 用PH试纸或PH计测试明矾溶液,pH < 7 证明溶液呈酸性
本题解析:明矾净水的原理是铝离子能水解Al3++3H2O Al(OH)3 +3H+,水解产生的氢氧化铝具有吸附能力,吸附水中悬浮物,明矾水解显酸性,要证明明矾发生了水解,只要证明溶液呈酸性就行,操作方法为:用PH试纸或PH计测试明矾溶液,pH < 7 证明溶液呈酸性,明矾发生了水解。
Al(OH)3 +3H+,水解产生的氢氧化铝具有吸附能力,吸附水中悬浮物,明矾水解显酸性,要证明明矾发生了水解,只要证明溶液呈酸性就行,操作方法为:用PH试纸或PH计测试明矾溶液,pH < 7 证明溶液呈酸性,明矾发生了水解。
考点:考查盐的水解等知识。
本题难度:一般
5、选择题 酸式盐NaHY的水溶液中,HY-的电离程度小于HY-的水解程度。下列有关叙述正确的是 ( )
A.HY-水解方程式为:HY-+ H2O H3O++ Y2-
H3O++ Y2-
B.在该盐的溶液中离子浓度大小关系为:c(Na+) >c(Y2-) >c(HY-) >c(OH-) >c(H+)
C.H2Y的电离方程式为:H2Y+H2O HY-+H3O+
HY-+H3O+
D.在该盐的溶液中:c(Na+) >c(HY-) >c(Y2-)>c(OH-)>c(H+)
参考答案:C
本题解析:HY-水解是与水电离出的H+结合生成H2Y,A项错误。HY-的电离程度小于HY-的水解程度说明该酸式盐溶液显碱性,c(HY)-?c(Y2-),B项错误。因为HY-水解说明H2Y为弱酸,H2Y电离是可逆的,C项正确。该盐溶液中,c(Y2-)最小,D项错误。
本题难度:困难