时间:2017-08-08 03:43:37
1、选择题 相同条件下,向100mL,pH=1的硫酸、醋酸、盐酸溶液中分别加入0.46gNa,产生氢气的体积分别为V1、V2、V3,则下列关系中,正确的是( )
A.V3<V2<V1
B.V3=V2=V1
C.V1=V3>V2
D.V1=V3<V2
参考答案:B
本题解析:
本题难度:一般
2、填空题 常温下有0.1mol?L-1五种溶液NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4.
(1)已知CH3COOH溶液的pH=3,其电离度为______,由水电离的c(H+)=______.
(2)相同pH的CH3COOH溶液和HCl溶液加水稀释,其pH变化情况如图,其中表示HCl溶液的是______曲线,a、b两点中,导电能力更强的是______.
(3)NH3?H2O溶液和HCl溶液等体积混合后,溶液呈酸性的原因是(离子方程式表示)______.此时,该混合溶液中的微粒浓度关系正确的是______.
A.c(Cl-)>c(H+)>c(NH4+)>c(OH-)B.c(Cl-)=c(NH4+)>c(OH-)=c(H+)
C.c(NH4+)+c(NH3?H2O)=0.1mol?L-1 D.c(H+)=c(NH3?H2O)+c(OH-)
(4)已知NH3?H2O和NH4Cl等浓度混合时溶液呈碱性,向NH4HSO4溶液中逐滴滴入NaOH溶液至中性时,溶液中各离子浓度的大小关系是______.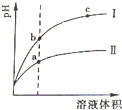
参考答案:(1)电离度=c(H+)c(CH3COOH)×100%=10-30.1×100%=1%;由水电离的c(H+)等于溶液中氢氧根离子浓度=10-1410-3mol/L=1×10-11mol.L-1,
故答案为:1%;1×10-11mol.L-1;
(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,稀释相同的倍数后,醋酸中氢离子浓度大于盐酸,所以pH变化大的为强酸,根据图象知,I为盐酸;
溶液的导电能力与离子浓度成正比,氢离子浓度越大溶液的pH越小,所以溶液导电能力较大的是a;
故答案为:?;a;
(3)等物质的量的氨水和盐酸混合时,二者恰好反应生成氯化铵,铵根离子水解而使溶液中氢离子浓度大于氢氧根离子浓度,则溶液呈酸性,水解离子方程式为NH4++H2O?NH3?H2O+H+,
A.氯化铵能水解但水解程度较小,所以c(H+)<c(NH4+),故错误;
B.铵根离子水解而使溶液呈酸性,所以c(OH-)<c(H+),故错误;
C.溶液中存在物料守恒,根据物料守恒得c(NH4+)+c(NH3?H2O)=0.05mol?L-1,故错误;
D.根据质子守恒得c(H+)=c(NH3?H2O)+c(OH-),故正确;
故答案为:NH4++H2O?NH3?H2O+H+;D;
(4)NH3?H2O和NH4Cl等浓度混合时溶液呈碱性,说明一水合氨电离程度大于铵根离子水解程度,向NH4HSO4溶液中逐滴滴入NaOH溶液至中性时,溶液中的溶质为硫酸铵、一水合氨和硫酸钠,钠离子不水解、铵根离子水解,溶液中存在电荷守恒c(Na+)+c(NH4+)=2c(SO42-),所以离子浓度大小顺序是c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-).
本题解析:
本题难度:一般
3、选择题 下列说法中,能说明酸HA的酸性比酸HB的酸性强的是
A.同温、同浓度的钠盐溶液PH:NaA>NaB
B.PH相同的HA,HB的酸溶液,稀释相同倍数后,PH:HA<HB
C.中和等体积、等PH的HA,HB溶液时,HA消耗NaOH的物质的量多
D.同温、同浓度的两种酸溶液,HA的电离程度大于HB的电离程度
参考答案:D
本题解析:A.根据“越弱越水解”可知,NaA水解程度大,故HA的酸性弱。A错误。
B.PH相同的酸溶液,稀释相同倍数,酸性越弱的溶液PH增大的越小,故HA的酸性弱,B错误。
C.中和等体积、等PH的HA,HB溶液时,HA消耗NaOH的物质的量多,说明HA的浓度大,电离程度小,酸性弱,C错误。
D.同温、同浓度的两种酸溶液,电离程度越大酸性越强,故HA的酸性强,D正确。
故选D
本题难度:一般
4、填空题 (12分)⑴① NH3?②SO3?③Cl2?④BaSO4?⑤酒精?⑥CH3COONH4?⑦HClO ⑧Cu。
以上物质中属于非电解质的是? ?,属于强电解质的是? ?。
⑵常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是? (填“A”或“B”),设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1?m2(填“<”、“=”、“>”)。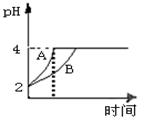
⑶在25℃时,有pH为a(a≤6)的盐酸和pH为b(b≥8)的NaOH溶液,取Va L该盐酸,与该NaOH溶液中和,需Vb LNaOH溶液。若a + b>15,则Va∶Vb = ? ?(填表达式),且Va Vb(填“>”“<”或“=”)
参考答案:⑴①②⑤;④⑥。?⑵B;<?⑶Va/Vb=1×10a+b-14;?>
本题解析:(1)溶于水和熔融状态下均不能导电的化合物是非电解质,所以答案是①②⑤。在溶液中能完全电离的电解质是强电解质,因此答案是④⑥。
(2)醋酸是弱电解质,存在电离平衡。在醋酸和锌的反应过程中,醋酸会继续电离出氢离子,所以在pH相等的条件下,醋酸溶液的pH变化程度小,因此B表示的是醋酸。由于在反应过程中醋酸会继续电离出氢离子,所以在pH变化相同的条件下,醋酸消耗的锌要多。
(3)如果盐酸的物质的量大于氢氧化钠的,则盐酸过量,溶液显酸性,反之显碱性。相等则显中性。若二者恰好完全反应时,则Va×10-a=Vb×1×10—14÷10—b,解得Va/Vb=1×10a+b-14。若a + b>15,则Va/Vb>10。
本题难度:一般
5、选择题 下列关于电解质溶液的判断正确的是(?)
A.60℃时,NaCl溶液的pH<7,则溶液呈酸性
B.将pH=4的CH3COOH溶液加水稀释,溶液中所有离子的浓度均减小
C.常温下,CH3COOH分子可能存在于pH>7的碱性溶液中
D.相同温度下,1 mol·L-1氨水与0.5 mol·L-1氨水中c(OH-)之比是2∶1
参考答案:C
本题解析:NaCl是强酸强碱盐,溶液始终显中性。A项错误。在整个稀释过程中,氢离子的物质的量一直是增大的,但氢离子浓度是先增大后减小,Kw=[H+][OH-]在一定温度下是一个定值,所以OH-浓度增大。B项错误。CH3COOH是弱酸,醋酸盐溶液中,CH3COO-+H2O CH3COOH+OH-就有CH3COOH分子存在。C项正确。NH3·H2O是弱碱,不同浓度下电离程度不同。D项错误。
CH3COOH+OH-就有CH3COOH分子存在。C项正确。NH3·H2O是弱碱,不同浓度下电离程度不同。D项错误。
本题难度:一般