时间:2017-08-06 11:48:33
1、选择题 下列四种原子晶体:①金刚石②晶体硅③SiC④SiO2,它们的熔点的高到低的顺序是
A.①④③②
B.①②③④
C.④①③②
D.④③①②
参考答案:A
本题解析:键长越短,键能越大,熔点越高
键长C—C<O—Si<C—Si<Si—Si
键能C—C>O—Si>C—Si>Si—Si
本题难度:一般
2、填空题 (14分)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如:
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
⑴写出铬的原子结构示意图为?与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有____________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为________。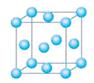
⑵ CCl4分子中C原子采取?杂化成键。
⑶ COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是?,其中碳氧原子之间共价键是?(填序号)
a.2个σ键?b.2个π键?c.1个σ键、1个π键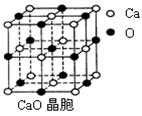
⑷ CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为?。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3401kJ?mol-1、NaCl-786kJ?mol-1。导致两者晶格能差异的主要原因是?。
参考答案:(14分)
⑴?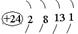 (2分)? K、Cu(各1分,多写此格不给分)? 4(1分)
(2分)? K、Cu(各1分,多写此格不给分)? 4(1分)
⑵ sp3(1分)?⑶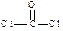 ?(2分)?c(2分)?
?(2分)?c(2分)?
⑷ 6?(2分)? Ca O晶体中离子的电
O晶体中离子的电 荷数大于NaCl (2分)
荷数大于NaCl (2分)
本题解析:略
本题难度:一般
3、选择题 最近科学家成功地制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是(?)。
A.该物质的化学式为CO4
B.晶体的熔、沸点高,硬度大
C.晶体中C原子数与C—O键数之比为1∶4
D.晶体的空间最小环共由12个原子所构成
参考答案:A
本题解析:分析题意可知,该新型碳氧化合物属于原子晶体,以C—O键结合为一种空间网状的无限伸展结构,使学生容易联想到晶体SiO2的结构,故B、C、D三项正确。该物质的化学式应为CO2,而不是CO4,故A项错误。
本题难度:一般
4、选择题 某离子晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶角和面心,则该晶体的化学式为(?)。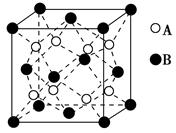
A.B2A
B.BA2
C.B7A4
D.B4A7
参考答案:B
本题解析:本题考查的是均摊法确定晶胞的化学式,考查学生综合运用能力,中等难度题。解题思路:8个A在晶胞的内部,全部属于这个晶胞;B位于顶角和面心,个数= ×8+6×
×8+6×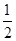 =4,故答案为B。
=4,故答案为B。
本题难度:一般
5、选择题 实现下列变化时,需克服相同类型作用力的是
A.二氧化硅和干冰的熔化
B.液溴和钠的气化
C.食盐和冰的熔化
D.纯碱和烧碱的熔化
参考答案:D
本题解析:二氧化硅是原子晶体,熔化克服的是共价键,干冰、液溴、冰形成的晶体都是分子晶体,熔化克服的是分子间作用力。氯化钠、纯碱和烧碱形成的都是离子晶体,熔化克服的是离子键,钠形成的晶体是金属晶体,熔化克服的是金属键,所以正确的答案选D。
本题难度:一般