时间:2017-08-06 11:36:01
1、简答题 下列关于化学键的说法正确的是( )
A.化学键是分子与分子之间的作用力
B.形成物质中的化学键时,要吸收能量
C.化学键的断裂和形成是化学反应中能量变化的主要原因
D.形成或断裂同一种化学键,放出或吸收的能量是不相等的,这是化学反应中能量变化的主要原因
参考答案:A、化学键是相邻原子之间的强烈的作用力,分子与分子之间的作用力为范德华力,故A错误;
B、形成化学键要放出能量,断裂化学键要吸收能量,故B错误;
C、化学反应的实质是旧键的断裂和新键的形成,形成化学键要放出能量,断裂化学键要吸收能量,则化学反应一定伴随着能量变化,故C正确;
D、一种化学键的键能是一定的,形成或断裂同一种化学键,放出或吸收的能量相同,故D错误.
故选C.
本题解析:
本题难度:一般
2、选择题 CH4催化还原NOx可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH=-574 kJ/mol
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g); ΔH=-1160 kJ/mol
下列说法不正确的是 ( )
A.反应①②均为放热反应
B.反应①②转移的电子数相同
C.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH=-a kJ/mol,a<574
D.若用标准状况下4.48 L CH4通过上述反应还原NO2至N2,放出的热量为173.4 kJ
参考答案:C
本题解析:A正确,ΔH<0为放热反应;B正确,C元素的化合价都由—4价升高到+4价;
C错,气态水变成液态水要放出热量,所以,a>574;C正确;由热化学反应方程式可得标准状况下4.48 L CH4通过上述反应还原NO2至N2,放出的热量为173.4 kJ
本题难度:困难
3、选择题 已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断 裂时吸收热量496 kJ,氢气中1 mol H
参考答案:
本题解析:
本题难度:简单
4、填空题 在一定条件下,可逆反应A(g)+B(g) mC(g);变化如下图所示。已知坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC(g);变化如下图所示。已知坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问: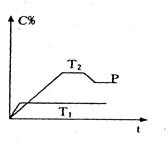
⑴T1?T2(填“大于”、“等于”或“小于”。
⑵正反应是?反应(填“吸热”或“放热”),m?2(填“大于”、“等于”或“小于”)。
⑶某温度下,反应物的起始浓度分别为:c(A)="1" mo1/L,c(B)=" 2.4" mo1/L;达到平衡后,A的转化率为0.60,此时B的转化率为?。
参考答案:⑴大于 ⑵放热,大于 ⑶25%
本题解析:(1)根据图像可知,T1首先得到平衡状态,所以温度是T1大于T2。
(2)温度越高,C的含量越低,这说明升高温度平衡向逆反应方向移动,所以正方应是放热反应。增大压强C的含量降低,说明增大压强,平衡向逆反应方向移动,所以正方应是体积增大的可逆反应,即m大于2。
(3)达到平衡后,A的转化率为0.60,则消耗A的物质的量是0.60mol,则根据方程式可知消耗B的物质的量是0.6mol,所以B的转化率是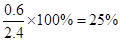 。
。
点评:该题是高考中的常见题型,属于基础性试题的考查,试题难易适中,主要是考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和应试能力。
本题难度:一般
5、填空题 下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ): 根据上述数据回答(1)~(6)题。

参考答案:(1)A
(2)A
(3)放热
(4)Cl2
(5)能 ;生成物越稳定,放出的热量越多,在HX中,HCl最稳定
(6)H2(g)+ Cl2(g)=2HCl(g) △H=-185 kJ·mol-1
本题解析:
本题难度:一般