时间:2017-08-06 11:27:16
1、选择题 在地壳中含量最多的金属元素是
[? ]
A.铁
B.氧
C.硅
D.铝
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列实验过程中产生的现象与右边座标图形相符合的是
A.稀盐酸滴加到一定量NaOH溶液中
(横坐标是稀盐酸的体积,纵坐标为钠离子物质的量)
B.铁粉加到一定量CuSO4溶液中
(横坐标是铁粉的质量,纵坐标为沉淀质量)
C.CO2通入一定量NaOH溶液中
(横坐标是CO2的体积,纵坐标为溶液的导电能力)
D.稀硫酸滴加到Ba(OH)2溶液中
(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
参考答案:D
本题解析:A.稀盐酸滴加到一定量NaOH溶液中,钠离子不参加任何反应,物质的量是不会改变的,不符合题意
B.由Fe+CuSO4=FeSO4+Cu可知,铁置换出了等物质的量的铜,固体的质量增大,反应停止后,保持不变,故不符合题意
C.可能依次发生的反应为:CO2+2NaOH=Na2CO3+H2O? CO2+NaOH=NaHCO3,而溶液导电性与离子浓度及离子所带电荷来决定,导电性基本上没有太大的改变,不符合题意
D.由反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,随着硫酸的滴加,生成了沉淀与水,溶液的电子能力逐渐减小到最弱,继续滴加,相当于是Ba(OH)2溶液,导电性再基本恢复,符合题意,选D
本题难度:简单
3、选择题 下列化学用语正确的是( )
A.聚丙烯的结构简式: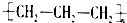
B.丙烷分子的比例模型: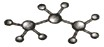
C.四氯化碳分子的电子式: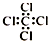
D.2-乙基-1,3-丁二烯分子的键线式: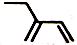
参考答案:D
本题解析:
本题难度:简单
4、选择题 已知33As、35Br位于同一周期,下列关系正确的是( )
A.还原性:As3->S2->Cl-
B.热稳定性:HCl>AsH3>HBr
C.原子半径:As>Cl>P
D.酸性:H3AsO4>H2SO4>H3PO4
参考答案:A.非金属性Cl>S>P>As,元素的非金属性越强,对应的阴离子的还原性越弱,则还原性As3->S2->Cl-,故A正确;
B.非金属性:Cl>Br>As,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.同周期元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大,则应有As>P>Cl,故C错误;
D.非金属性S>P>As,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性H2SO4>H3PO4>H3AsO4,故D错误.
故选A.
本题解析:
本题难度:简单
5、填空题 (1)把下列式子改成氧化物形式
①正长石(KAlSi3O8)?
②蛇纹石(H4Mg3Si2O9)?
(2)写出下列物质间的关系:红磷与白磷?,
35Cl和37Cl?
(3)写出除去括号中杂质的方法:
碳酸钠固体(碳酸氢钠晶体)?
SiO2固体 (CaO) ?
CO2 (SO2 ) ?
(4)写出稀硝酸与金属银在加热条件下反应的离子方程式:
?
将PbO2放入浓盐酸中会产生Cl2?,此反应的化学方程式为:
?
(5)标准状况下,在三个容积相同的干燥的烧瓶中,甲瓶装入干燥纯净的NH3,乙瓶装入含四分之一体积空气的HCl,丙瓶装入NO2和O2(体积比为4:1),以水为溶剂作喷泉实验。实验结束后三个烧瓶中溶液的物质的量浓度之比为?,丙瓶中发生反应的总化学方程式为?
参考答案:(1)K2O·Al2O3 ·6SiO2?3MgO·2SiO2· 2H2O
(2)同素异形体,同位素
(3)加热至不再产生气体为止
加过量盐酸后过滤
加溴水或酸性高锰酸钾溶液
(4)3Ag + 4H+ + NO3-= 3Ag+ + NO↑ +2H2O
PbO2 + 4HCl(浓)=PbCl2 +Cl2↑ + 2H2O
(5)1:1: 1/28 或 28:28:1
4NO2 +O2 +2H2O=4HNO3
本题解析:略
本题难度:简单