时间:2017-08-06 11:25:26
1、填空题 化合物SOCl2是一种液态化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察 到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
(1)根据上述实验,写出SOCl2和水反应的化学方程式____________。
(2) AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O混合共热,可得到无水AlCl3,其原因是______________。
参考答案:(1)SOCl2+H2O==SO2+2HCl
(2)若AlCl3溶液蒸干灼烧, AlCl3在水中存在如下平衡:AlCl3+3H2O Al(OH)3+3HCl, 蒸干和灼烧过程中,HCl挥发,Al(OH)3分解:2Al(OH)3
Al(OH)3+3HCl, 蒸干和灼烧过程中,HCl挥发,Al(OH)3分解:2Al(OH)3 Al2O3+3H2O↑,因此固体产物主要为Al2O3,SOCl2和水反应生成SO2和HCl,一方面使水的物质的量减少,另一方面生成的酸抑制AlCl3的水解,所以SOCl2和AlCl3·6H2O共热可得AlCl3
Al2O3+3H2O↑,因此固体产物主要为Al2O3,SOCl2和水反应生成SO2和HCl,一方面使水的物质的量减少,另一方面生成的酸抑制AlCl3的水解,所以SOCl2和AlCl3·6H2O共热可得AlCl3
本题解析:
本题难度:一般
2、选择题 根据化学平衡知识,判断下列 说法正确的是(?)
说法正确的是(?)
A.已知NaHA溶液呈弱碱性,则该溶液中下列各种微粒浓度大小排列顺序为:
c(Na+)>c(HA-)>c(A2-)>c(H2A)
B.在小苏打溶液中存在下列关系:c(HCO3-)=c(Na+)-c (CO32-)-c(H2CO3)
C.向AgCl悬浊液中加入足量的NaI溶液,无明显现象产生
D.常温下,稀释0.1 mol/L的氨水,溶液中所有离子浓度均下降
参考答案:B
本题解析:略
本题难度:一般
3、选择题 有各100ml浓度0.10 mol/L的下列四种溶液其中包含阴离子总数最多的是:
A.NaCl
B.NaF
C.NaAc
D.NaCN
参考答案:A
本题解析:四选项物质均为一元酸的钠盐NaA,均存在电荷守恒:c(Na+)+c(H+)=c(A—+c(OH—),为了比较阴离子总数,我们可以以阳离子总数为参照物:
四溶液中后三者均为强碱弱酸盐,呈碱性,而NaCl溶液为中性溶液,相对来说,c(H+)最大,所以NaCl溶液中c(Na+)+c(H+)最大,故阴离子总数也最多,答案为A
本题难度:一般
4、填空题 (10分)化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。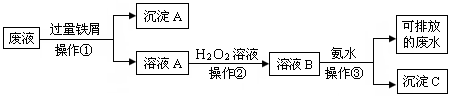 ?
?
(1)操作①的名称是?。
(2)操作②反应时还需加入少量硫酸,操作②中观察到的实验现象是?。
(3)操作②中发生反应的离子方程式为?。
(4)简述以沉淀A为原料制得金属铜和绿矾晶体(FeSO4·7H2O)的实验方案。
?
参考答案:(1)过滤?(2)溶液由浅绿色变为棕黄色,有少量气泡出现。
(3)2Fe2+ + H2O2 + 2H+ = 2Fe3+ + H2O
(4)在沉淀中加入稀硫酸,搅拌,至不再有气泡产生,过滤,洗涤固体并干燥得铜。滤液加热浓缩后冷却结晶,过滤,干燥得绿矾。
本题解析:(1)分离溶液和沉淀应用过滤方法(2)溶液A中含亚铁离子,过氧化氢溶液有氧化性,可将亚铁离子氧化成铁离子,铁离子为棕黄色,过氧化氢本身被还原成氧气,故有气泡冒出(3)亚铁离子被氧化,过氧化氢被还原(4)沉淀A含铁和铜,加入稀硫酸将铁转化为FeSO4,再加热浓缩后冷却结晶,过滤,干燥得绿矾。
本题难度:一般
5、选择题 在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶掖等体积混合后,下列关系式中正确的是
A.c (Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH一)
C.c (Na+) > c (CH3COO-)>c(OH-)>c(H+)
D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-)
参考答案:D
本题解析:25℃时pH=11 的NaOH 溶液,c(OH-)=10-3mol/L; pH=3 的CH3COOH溶掖c(H+)=10-3mol/L.由于NaOH是强碱,完全电离,而醋酸是弱酸,部分电离。因此c(CH3COOH)>c(NaOH)。根据物料守恒c (Na+)<c(CH3COO-)+c(CH3COOH)。A错误。在该溶液中CH3COOH电离产生的H+被NaOH中和一部分,所以在反应后的溶液中的H+由过量的醋酸与水共同电离产生,而CH3COO-则是CH3COOH与CH3COONa共同电离产生的。因此c(H+)<c(CH3COO-)+c(OH一) 。B错误。当二者等体积混合时,由于酸过量,所以溶液为CH3COOH与CH3COONa的混合溶液。由于醋酸的电离作用大于醋酸根离子的水解作用。所以溶液显酸性,c(H+)>c(OH-)。在CH3COONa固体中c(Na+)=" c" (CH3COO-)(开始)。但是在溶液中还存在CH3COOH电离产生的CH3COO-离子。因此c (CH3COO-)>c(Na+)。盐的电离作用远大于弱酸的电离作用,所以c(Na+)>c(H+)。故c (CH3COO-)>c(Na+)>c(H+)>c(OH-)。C错误,D正确。
本题难度:一般