时间:2017-08-06 11:22:09
1、填空题 水是宝贵资源,研究生活和工业用水的处理有重要意义。请回答下列问题:
(1)已知水的电离平衡曲线如图所示。A、B、C三点水的电离平衡常数KA、KB、KC关系为?,若从B点到D点,可采用的措施是 ?(填序号)。
?(填序号)。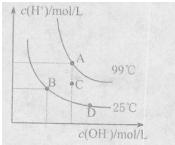
a。加入少量盐酸?
b.加人少量碳酸钠
c.加人少量氢氧化钠
d.降低温度?
(2)饮用水中的NO3-主要来自于NH4+。已知在微生物的作用下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下: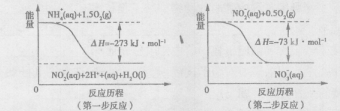
1 molNH4+全部被氧化成NO3-的热化学方程式为?。
(3)某工厂用电解法除去废水中含有的Cr2O72-,总反应方程式为:
Cr2O72-+6Fe+17H2O+2H+?2Cr(OH)3↓+6Fe(OH)3↓+6H2↑,该电解反应的负极材料反应的电极式为?,若有9 mol电子发生转移,则生成的cr(OH)3物质的量为?。
(4)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中。常含有较多的NH4+和PO43-,其中一种方法是:在废水中加人镁矿工业废水,可以生成高品位的磷矿石——鸟粪石,反应的离子方程式为Mg2++NH4++PO43-?MgNH4PO4↓。该方法中需要控制污水的pH为7.5—10,若pH高于l0.7,鸟粪石产量会降;低,其原因可能是?。
参考答案:
本题解析:略
本题难度:一般
2、选择题 下列有关热化学方程式的叙述正确的是
[? ]
A.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B.已知c(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热化学方程式为:
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
参考答案:C
本题解析:
本题难度:简单
3、选择题 对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1 mL稀释至100 mL后,? pH="3"
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为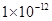
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A.①②
B.①③
C.②④
D.③④
参考答案:A
本题解析:硝酸是强酸,稀释100倍后溶液的pH增大2个单位,①正确;硝酸和氢氧化钡都是强酸和强碱,且溶液中氢离子和OH-浓度都是相等的,二者恰好反应,溶液显中性,②正确;溶液中水电离出的c(H+)就等于溶液中OH-浓度,所以根据水的离子积常数可知,该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为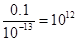 ,③不正确;④不正确,此时二者恰好反应,但生成的氯化铵水解,溶液显酸性,答案选A。
,③不正确;④不正确,此时二者恰好反应,但生成的氯化铵水解,溶液显酸性,答案选A。
点评:在判断中和反应后溶液的酸碱性时,应该首先判断酸或碱的过量问题。只有当酸或碱恰好反应时,才能考虑生成的盐是否水解。
本题难度:一般
4、填空题 (共4分)25℃时,PH = 10.0的KOH溶液中,由水电离出的(OH-)=____________mol/L;
pH = 12.0的KCN溶液中,由水电离出来的(H+)=______________mol/L。
参考答案:10-10?;? 10-2
本题解析:考查pH的有关计算。
在pH=10.0的氢氧化钾溶液中,氢离子浓度是10-10mol/L,由于氢氧化钾是抑制水的电离的,所以溶液中由水电离出的OH-浓度也是10-10mol/L;在pH = 12.0的KCN溶液中,溶液中OH-浓度是10-2mol/L。由于KCN是促进水的电离的,所以由水电离出来的(H+)=10-2mol/L。
本题难度:一般
5、选择题 下列说法不正确的是
A.电能是现代社会中应用最广泛、使用最方便、污染最小的一种能源
B.酶比其他催化剂有更高的选择性和催化效率,因此“仿酶催化”是化学研究的一个重要主题
C.将煤制成煤气,可以提高燃烧效率
D.增加炼铁高炉的高度,使CO与氧化铁充分反应,可以消除高炉尾气中的CO
参考答案:D
本题解析:略
本题难度:简单