时间:2017-08-06 11:03:28
1、选择题 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是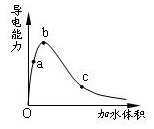
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
C.a、b、c三点中b点n(H+)最大
D.a、b、c三点醋酸的电离程度:a<b<c
参考答案:D
本题解析:酸电离平衡为:CH3COOH CH3COO—+H+
CH3COO—+H+
冰醋酸加水稀释过程中,电离度一直在增大,但醋酸浓度一直在减小,而c(H+)=cα;从图中可看出c(H+)是先增大后减小。而c(H+)决定了溶液的酸碱性及导电能力。但在稀释过程中,CH3COOH的量不会改变,故中和时所耗氢氧化钠的量是不会改变的。
本题难度:一般
2、选择题 (6分)(2012?广东)对于常温下pH为2的盐酸,传述正确的是( )
A.c(H+)=c(Cl
参考答案:
本题解析:
本题难度:一般
3、选择题 常温下pH均为2的两种酸溶液X和Y各10mL分别加水稀释到10000mL,其pH与所加水的体积变化如图所示,下列结论中正确的是( )
A.加水后,Y酸的电离度增大
B.X酸在水溶液中存在电离平衡
C.加水后,X酸的电离平衡常数减小
D.X酸的物质的量浓度与Y酸的物质的量浓度相等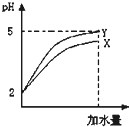
参考答案:B
本题解析:
本题难度:简单
4、选择题 常温下,0.1mol/L氨水溶液中
| c(H+) c(OH-) |
参考答案:A.常温下,0.1mol/L氨水溶液中c(H+)c(OH-)=1×10-8,c(OH-).c(H+)=1×10-14,所以c(H+)=1×10-11mol/L,故A正确;
B.等物质的量的氨水和盐酸恰好反应生成氯化铵,根据电荷守恒知c(NH4+)+c(H+)=c(Cl-)+c(OH-),故B正确;
C.0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后恰好反应生成硫酸铵,溶液中存在物料守恒:c(NH4+)+c(NH3)+c(NH3?H2O)=2c(SO42-),故C正确;
D.浓度为0.1 mol/L的NH3?H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,说明氨水的电离程度大于铵根离子的水解程度,则c(NH4+)>c(NH3?H2O),氯离子不水解,所以c(Cl-)>c(NH3?H2O),则c(NH4+)>c(Cl-)>c(NH3?H2O)>c(OH-)>c(H+),故D错误.
故选D.
本题解析:
本题难度:简单
5、选择题 HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述中不正确的是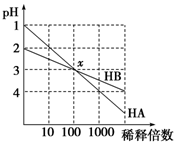
A.HA是一种强酸
B.x点,[A-]=[B-]
C.HB是一种弱酸
D.原溶液中HA的物质的量浓度为HB的10倍
参考答案:D
本题解析:A、根据图像可知HA稀释前pH=1,稀释100倍后pH=3,这说明在稀释过程中氢离子的物质的量不变,因此HA是强酸,A正确;B、x点两种溶液的pH相等,则根据电荷守恒可知[H+]=[OH-]+[A-]、[H+]=[OH-]+[B-],所以x点,[A-]=[B-],B正确;C、稀释前HB的pH=2,稀释100后pH=3,这说明在稀释过程中溶液中氢离子的物质的量是增加的,因此溶液中存在电离平衡,所以HB是弱酸,C正确;D、稀释前HA的浓度是0.1mol/L。但由于HB是弱酸,不能确定HB的浓度,所以无法计算原溶液中HA的物质的量浓度与HB的物质的量浓度关系,D不正确,答案选D。
本题难度:一般