时间:2017-08-06 10:40:53
1、选择题 等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6(相同状况),则甲、乙两烧杯中的反应情况可能分别是
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
参考答案:B
本题解析:HCl、NaOH与Al发生反应的方程式为2Al+6HCl=2AlCl3+3H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑。由方程式可以看出等体积、等物质的量浓度的盐酸、氢氧化钠溶液若是与足量的Al发生反应放出的氢气体积比为1:3.。现在放出的气体的体积比为5:6>1:3,说明Al对于酸来说是过量的,对于NaOH来说是不足量的。因此选项为B。
本题难度:一般
2、选择题 称取两份铝粉,第一份加入足量的浓氢氧化钠溶液,第二份加入足量的稀盐酸,如要放出等体积的气体(在同温同压下),两份铝的质量之比为……( ?)
A.1:2
B.1:3
C.3:2
D.1:1
参考答案:D
本题解析:铝能与酸及强碱溶液发生氧化还原反应放出氢气。反应中铝均作还原剂,而产生的氢气都是由H+(盐酸或水中)得电子被还原而成的,根据在氧化还原反应中得、失电子总数相等的原则,可快速求解。
铝与盐酸反应时,由Al→Al3+;铝与浓NaOH反应时,Al→AlO2-,每摩铝均失去3摩电子。而产生氢气都是由H+(盐酸或水中)得电子被还原:2H++2e=H2↑,根据氧化还原反应中得失电子总数相等的原则,既然放出氢气的体积相等,那么在两个反应中消耗的铝的物质的量一定相等,故质量也相等,即应选D。
本题难度:一般
3、填空题 现有等物质的量的Mg和Al的混合物a g与100 ml盐酸反应,(气体体积均以标准状况计算)
(1)、该混合物中Mg和Al的质量比为?
(2)、如果金属与盐酸恰好完全反应,则盐酸的浓度为?
(3)、如果反应后金属有剩余,盐酸不足,要计算生成H2的体积,还需要知道?
参考答案:
(1)、质量比为 8:9?(2)、盐酸的浓度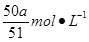
(3)、还需要知道盐酸的浓度或者盐酸的体积
(4)、H2的体积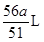
(5)、范围?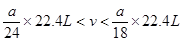
本题解析:
(1)设Mg是XgAl是Yg;则有X24=Y/27,可知X:Y=8:9
(2)根据电荷守恒可得:Mg→Mg2+,Al→Al3+ ,则有:[(8/17/24)2+(9/17/27)3]a/0.1=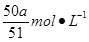
(3)H2中的氢全部来自于盐酸,所以只需知道盐酸的物质的量,就可知道生成的氢气的体积,题干中已知盐酸体积,所以只需知道盐酸的浓度即可。
点评:本题涉及到了混合物与酸反应的定量计算,计算难度提升,学生在解题时不但利用方程式解析,还需要利用元素守恒,电荷守恒等。
本题难度:简单
4、选择题 将表面已完全氧化的铝条,插入下列溶液中,不会发生反应的是(? )
A.稀硝酸
B.稀盐酸
C.硝酸铜
D.氢氧化钠
参考答案:C
本题解析:A可以反应,稀硝酸为强氧化性酸,能与大多数金属反应;B可以反应,稀盐酸能与氧化铝反应,反应后能与AL进一步反应;C不可以;D可以反应,氧化铝为典型的两性氧化物能与强碱反应,且铝也能与强碱反应;
本题难度:一般
5、填空题 工业上,将黄铜矿(CuFeS2)通过8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。
8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。
(1)上述反应中,还原剂为?。
(2)黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
a.通过上述②,炉渣中的Al2O3变成了?(写离子)。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸?稀硫酸? KSCN溶液?酸性KMnO4溶液? NaOH溶液?碘水
所选试剂为?。
证明炉渣中含有FeO的实验现象为?。
(3)对上述炉渣中进行含铁量的测定步骤如下: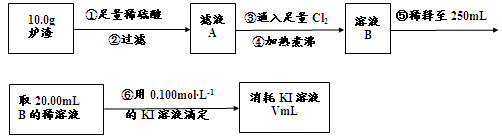
I.步骤③发生反应的离子方程式为?。
II.步骤④中煮沸的作用是?。
III.步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、?。
IV.若滴定过程中消耗0.100mol·L?1KI溶液20.00mL,则炉渣中铁的百分含量为?。
参考答案:(1)CuFeS2 (2)a.[Al(OH)4]-或AlO2-?b.稀硫酸、酸性KMnO4溶液;稀硫酸浸取炉渣所得溶液使酸性KMnO4溶液褪色(3)I.2Fe2++Cl2= 2Fe3++2Cl-II.赶走溶液中溶解的过量的Cl2?III.250mL容量瓶?(未答“250mL”不给分)IV.14%
本题解析:(1)在反应中CuFeS2中铁元素的化合价由+2价变为+3价,硫元素的化合价由-2价变为+4价做还原剂;(2)①用稀盐酸浸取炉渣发生的反应为:Al2O3 + 6H+=2Al3+ + 3H2O?
FeO + 2H+ = Fe2+ + H2O? Fe2O3 + 6H+ = 2Fe3+ + 3H2O ?②滤液中含有的金属阳离子有Al3+、Fe2+和Fe3+,氧化后含有Al3+和Fe3+,加过量氢氧化钠溶液发生的反应:Al3+ + 4OH-=AlO2- + 2H2O? Fe3+ + 3OH- = Fe(OH)3↓? a、通过上述②,炉渣中的Al2O3变成了AlO2-;b验证炉渣中含有+2价的铁,应先加入稀硫酸溶解,生成亚铁离子,具有还原性,可与高锰酸钾发生氧化还原反应,酸化时不能加入盐酸,否则与高锰酸钾发生氧化还原反应,也不能直接加入硝酸,否则生成铁离子,不能检验,故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液含有亚铁离子,与高锰酸钾发生氧化还原反应而使高锰酸钾褪色,故答案为:稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色;(3)分析工艺流程图发生的反应为:炉渣加足量稀硫酸:Al2O3 + 6H+=2Al3+ + 3H2O? FeO + 2H+ = Fe2+ + H2O? Fe2O3 + 6H+ = 2Fe3+ + 3H2O过滤,滤液中含有的金属阳离子有Al3+、Fe2+和Fe3+,通入足量Cl2:2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 滴定原理:2Fe3+ + 2I- = 2Fe2+ + I2I.步骤③通入足量氯气发生反应的离子方程式为2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ;II.过量的氯气能氧化I-,会影响实验结果,所以步骤④中煮沸的作用是赶走溶液中溶解的过量的Cl2;。III.步骤⑤为溶液的配制,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶。IV.滴定过程中发生的反应为2Fe3+ + 2I- = 2Fe2+ + I2,由反应式知n(I-)= n(Fe3+)=0.002mol,结合流程图知10.0g炉渣中铁的物质的量为0.025mol,质量为1.4g,质量分数为14%。
本题难度:困难