时间:2017-08-06 10:25:31
1、选择题 下列说法正确的是( )
A.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
B.分别中和等体积、等pH的盐酸和醋酸,消耗的NaOH物质的量相同
C.在101kPa时,1mol碳燃烧放出的热量就是碳的燃烧热
D.水的电离过程是吸热过程,升高温度,水的离子积增大、纯水的pH减小
参考答案:A、FeCl3溶液和Fe2(SO4)3溶液中,三价铁离子水解生成氢氧化铁,加热蒸干得到氢氧化铁,灼烧时氢氧化铁分解生成氧化铁和水,故A错误;
B、盐酸是强酸,醋酸是弱酸,等体积、等pH的盐酸和醋酸,醋酸的物质的量大,所以消耗的NaOH物质的量大,故B错误;
C、在101kPa时,1mol碳燃烧生成二氧化碳气体时放出的热量即为碳的燃烧热,故C错误;
D、水的电离过程是吸热过程,升高温度,平衡向右移动,水的离子积增大,氢离子浓度增大,所以pH减小,故D正确.
故选D.
本题解析:
本题难度:一般
2、填空题 (5分)某二元酸(化学式用H2A表示)在水中的电离方程式是:?
H2A====H++HA;HA-?H++A2-回答下列问题:
(1)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是:——。
A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1? B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)==c(oH-)+c(HA-)+2c(A2-)? D.c(Na+)=2c(A2-)+2c(HA-)
(2)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能
是?0.11 mol·L-1 (填“<”,“>”,或“=”),理由是:?
参考答案:
本题解析:由H2A的电离方程式:第一步电离全部电离,第二步为部分电离可知,H2A为强酸,而HA-为弱酸,所以在Na2A溶液中不存在H2A分子,所以
(1)A错,溶液中不存在H2A分子;B正确,质子守恒;C正确,电荷守恒;D正确,物料守恒;
(2)因H2A第一步电离产生的氢离子抑制了HA-的电离,所以,在0.1mol·L-1 H2A溶液中氢离子的物质的量浓度小于0.11 mol·L-1;
本题难度:简单
3、选择题 印染工业常用亚氯酸钠(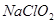 )漂白织物。亚氯酸钠在溶液中可生成
)漂白织物。亚氯酸钠在溶液中可生成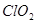 、
、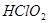 、
、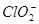 ,其中
,其中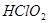 是漂白剂的有效成分,
是漂白剂的有效成分,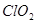 是有毒气体。各组分含量随pH变化如图所示,由图可知,使用该漂白剂的最佳pH为
是有毒气体。各组分含量随pH变化如图所示,由图可知,使用该漂白剂的最佳pH为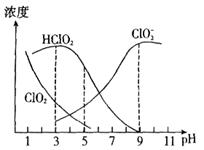
A.3.0
B.4.0~4.5
C.6.5~7.0
D.9.0
参考答案:B
本题解析:根据图像可知,酸性太强时,容易生成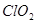 ,而酸性太弱时,又生成
,而酸性太弱时,又生成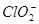 。因此pH在4.0~4.5之间时
。因此pH在4.0~4.5之间时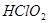 相等最多,所以答案选B。
相等最多,所以答案选B。
本题难度:简单
4、选择题 25℃时,下列说法正确的是
A.pH =8.3的NaHCO3溶液:c( Na+)>c( HC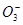 )>c(C
)>c(C 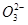 )>c( H2CO3)
)>c( H2CO3)
B.中和同浓度同体积的盐酸和醋酸,消耗的NaOH的物质的量不相同
C.用一定浓度的NaOH溶液滴定氢氟酸,当pH =6时,溶液中c(F—)—c(Na+)=9.9×l0—7 mol/L
D.用NaOH溶液滴定HCI与CH3COOH的混合溶液至中性时,溶液中的酸被完全中和
参考答案:C
本题解析:A、pH =8.3的NaHCO3溶液,溶液呈碱性,说明水解大于电离,c( H2CO3)>c(C 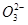 ),A不正确;B、同浓度同体积的盐酸和醋酸中溶质的物质的量相同,中和同浓度同体积的盐酸和醋酸,消耗的NaOH的物质的量相同,B不正确;C、由电荷守恒,c(F—)—c(Na+)=c(H+ )—c(OH―)=10―6―10―8=9.9×l0—7 mol/L,C正确;D、醋酸是弱酸,中和至中性时,溶液中酸过量,D不正确;选C。
),A不正确;B、同浓度同体积的盐酸和醋酸中溶质的物质的量相同,中和同浓度同体积的盐酸和醋酸,消耗的NaOH的物质的量相同,B不正确;C、由电荷守恒,c(F—)—c(Na+)=c(H+ )—c(OH―)=10―6―10―8=9.9×l0—7 mol/L,C正确;D、醋酸是弱酸,中和至中性时,溶液中酸过量,D不正确;选C。
考点:电解质溶液
本题难度:一般
5、选择题 常温下,向0.1mol/L的H2SO4溶液中逐滴加入物质的量浓度相同的Ba(OH)2溶液,生成沉淀的质量和加入Ba(OH)2溶液的体积关系如下图所示,下列有关说法正确的是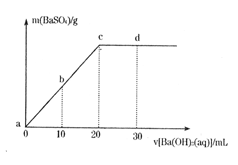
A.溶液的导电能力:a>b>c>d
B.溶液的pH:a<b<c<d
C.c点溶液和d点溶液均呈碱性
D.b点溶液中c(H+)和d点溶液中c(OH—)相等
参考答案:B
本题解析:稀硫酸和氢氧化钡反应的化学方程式是H2SO4+Ba(OH)2=2H2O+BaSO4↓,所以根据图像可知c点二者恰好反应生成硫酸钡白色沉淀,此时溶液的导电能力最弱,溶液显中性,A和D都不正确;b点溶液中氢离子的物质的量和d点溶液中OH—的物质的量相等,但浓度不相等,D不正确,答案选B。
点评:该题是中等难度的试题,试题贴近高考,侧重考查学生的能力和解题方法的培养和指导。有利于调动学生的学习积极性,也有助于培养学生的逻辑推理能力和创新思维能力,提高学生分析问题、概念、总结和解决问题的能力。
本题难度:一般