时间:2017-08-06 10:15:14
1、选择题 将0.1 L含有0.02mol CuSO4和0.01molNaCl的水溶液用惰性电极电解。电解一段时间后,一个电极上得到0.01 mol Cu,另一电极析出的气体
A.只有Cl2
B.只有O2
C.既有Cl2又有O2
D.只有H2
参考答案:C
本题解析:溶液中含有n(Cu2+)=0.02mol,n(Cl-)=0.01mol;用惰性电极电解,电解一段时间后,一个电极上得到0.01mol Cu,是阴极反应,另一电极析出的气体为阳极反应;发生的电极反应为:阳极电极反应:2Cl--2e-=Cl2↑;根据得到铜物质的量计算电子转移,阳极电子转移守恒分析判断离子反应情况;阳极电极反应:2Cl- - 2e- =Cl2↑;
0.01mol 0.01mol
4OH- - 4e-= 2H2O+O2↑
0.01mol 0.01mol
阴极电极反应:Cu2++2e-=Cu;
0.02mol 0.01mol
依据上述分析和计算得到,阳极反应生成的气体是氧气和氯气;答案选C。
考点:考查原电池和电解池的工作原理。
本题难度:一般
2、选择题 常温时,用某新型充电电池电解如右图所示的l00mL溶液,充电电池的总反应为
4Li+2SOCl2  ?4LiCl +S+SO2,则下列叙述中不正确的是
?4LiCl +S+SO2,则下列叙述中不正确的是
A.若仅闭合K2,铁极的电极反应式:Fe - 2e=Fe2+
B.放电时电池上正极的电极反应式为:2SOCl2+4e =4C1-+S+SO2
C.若仅闭合K1,电子由Fe极沿导线流向C极
D.若不考虑气体溶解和溶液体积变化,当电池中生成0. 025molS时,溶液中pH=14
参考答案:A
本题解析:若仅闭合K2,铁极与电源的负极相连,最阴极,溶液中的氢离子放电,选项A不正确;原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,则根据反应式可知,选项B正确;若仅闭合K1,则相当于是钢铁的吸氧腐蚀,电子由Fe极沿导线流向C极,选项C正确;当电池中生成0. 025molS时,转移电子是0.025mol×4=0.1mol,则溶液中一定生成0.1mol氢氧化钠,其浓度是1mol/L,选项D正确,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导,有助于培养学生逻辑推理能力,提高学生灵活运用电化学原理解决实际问题的能力。该类试题关键是明确原电池和电解池的工作原理,然后结合题意灵活运用即可。
本题难度:简单
3、填空题 (1)、①用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)=N2O4(g) ΔH=+10.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543kJ·mol-1
写出气态肼和N2O4反应的热化学方程式: 。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,其很容易转化为二氧化氮。试推断由二氧化氮制取四氧化二氮的反应条件(或措施): 。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。
图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e →2O2-)
①c电极为 ,d电极上的电极反应式为 。
②图乙是电解100mL 0.5mol·L-1 CuSO4溶液,a电极上的电极反应式为 。若a电极产生56mL(标准状况)气体,则所得溶液的pH= (不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入 (选填字母序号)
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
参考答案:(14分)
(1)①2 N2H4(g) + N2O4(g)= 3N2(g)+4H20(g) △H=-1096.7KJ·mol-1(2分)
②加压、降温(各1分)
(2)①正极(2分) CH4 - 8e- + 402-=CO2+2H2O (2分)
②4OH—- 4e-=2H2O+O2 (2分) 1 (2分) a、c (2分)
本题解析:(1)①a、N2(g)+2O2(g)=N2O4(g)△H=10.7kJ·mol-1;b、N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ·mol-1
依据盖斯定律b×2-a得到 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1096.7KJ·mol-1;
答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1096.7KJ·mol-1;
②四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮,由二氧化氮制取四氧化二氮,2NO2 N2O4,反应是放热反应,反应前后气体体积减小所以反应条件为:增大压强、降温都有利于反应正向进行;
N2O4,反应是放热反应,反应前后气体体积减小所以反应条件为:增大压强、降温都有利于反应正向进行;
故答案为:增大压强、降温;
(2)①图1是原电池,依据电流流向是从正极流向负极,c电极为正极,氧气得到电子发生还原反应,d电极为电池负极甲烷是电子发生还原反应,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子,结合电子守恒写出电极反应为:CH4- 8e-+4O2-=CO2+2H2O;
答案为:正极; CH4- 8e-+4O2-=CO2+2H2O;
②如图2所示电解100mL0.5mol?L-1CuSO4溶液,发生的电解池反应为:2CuSO4+2H2O 2Cu+O2↑+2H2SO4,与电源正极相连的为阳极,溶液中 氢氧根离子是电子发生氧化反应,电极反应为:4OH--4e-=2H2O+O2↑;若a电极产生56mL(标准状况)气体为氧气,物质的量为0.0025mol,消耗氢氧根离子物质的量为0.01mol,溶液中生成氢离子物质的量为0.01mol,c(H+)=
2Cu+O2↑+2H2SO4,与电源正极相连的为阳极,溶液中 氢氧根离子是电子发生氧化反应,电极反应为:4OH--4e-=2H2O+O2↑;若a电极产生56mL(标准状况)气体为氧气,物质的量为0.0025mol,消耗氢氧根离子物质的量为0.01mol,溶液中生成氢离子物质的量为0.01mol,c(H+)=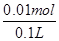 =0.1mol·L-1,PH=-lg0.1=1;则所得溶液电解过程中CuSO4溶液每损失2个Cu原子,就损失2个 O原子,相当于损失一个CuO,为了使CuSO4溶液,恢复原浓度,应加入CuO,也可以加入CuCO3,符合恢复溶液浓度的定量关系,但不能加入Cu(OH)2、Cu2(OH)2CO3,因为CuCO3+H2SO4
=0.1mol·L-1,PH=-lg0.1=1;则所得溶液电解过程中CuSO4溶液每损失2个Cu原子,就损失2个 O原子,相当于损失一个CuO,为了使CuSO4溶液,恢复原浓度,应加入CuO,也可以加入CuCO3,符合恢复溶液浓度的定量关系,但不能加入Cu(OH)2、Cu2(OH)2CO3,因为CuCO3+H2SO4 CuSO4+CO2↑+H2O,相当于加CuO,而Cu(OH)2+H2SO4
CuSO4+CO2↑+H2O,相当于加CuO,而Cu(OH)2+H2SO4 CuSO4+2H2O、Cu2(OH)2CO3+2H2SO4=2CuSO4 +CO2↑+3H2O,除增加溶质外还增加了水;选ac.
CuSO4+2H2O、Cu2(OH)2CO3+2H2SO4=2CuSO4 +CO2↑+3H2O,除增加溶质外还增加了水;选ac.
答案为:4OH—- 4e-=2H2O+O2 ;1;ac;
考点:热化学方程式;化学电源新型电池
本题难度:困难
4、简答题 用菱锰矿(MnCO3)常含有Fe2O3、FeO、HgCO3·2HgO等杂质,工业常用菱锰矿制取锰,工艺流程如下:
请回答下列问题:
(1)向粗液1中加入的水最后需要 方法才能达到技术要求。
(2)流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是 。
(3)净化剂主要成分为(NH4)2S,粗液2中发生主要反应的离子方程式为 。
(4)写出阳极的电极反应式 。说明电解液循环的原因 。
(5)写出铝热法炼锰的化学方程式 。
参考答案:(1)蒸馏
(2)空气中的氧气和氮气透过分离膜的能力不同
(3)Hg2++S2-=HgS↓
(4)Mn2++2H2O-2e-=MnO2+4H+;回收未反应的Mn2+,提高二氧化锰的产率。
(5)3MnO2+4Al 2Al2O3+3Mn
2Al2O3+3Mn
本题解析:(1)向粗液1中加入的水最后需要蒸馏达到浓缩的目的,使溶质的浓度增大。
(2)流程中用的空气是用膜分离法制备的富氧空气,其原理为空气中的氧气和氮气透过分离膜的能力不同,故答案为:空气中的氧气和氮气透过分离膜的能力不同;
(3)粗液2中发生主要反应的离子方程式为Hg2++S2-=HgS↓;
(4)净液主要含硫酸锰,电解时锰离子放电生成二氧化锰,则阳极反应式为Mn2++2H2O-2e-=MnO2+4H+;电解液循环利用是因回收未反应的Mn2+,提高二氧化锰的产率。
(5)铝热法炼锰的化学方程式为3MnO2+4Al 2Al2O3+3Mn。
2Al2O3+3Mn。
本题难度:一般
5、选择题 在标准状况下,用铂电极电解CuSO4溶液,当阴极产生12.8g铜时,阳极放出的气体是(?)
A.1.12LH2
B.1.12LO2
C.2.24LH2
D.2.24LO2
参考答案:D
本题解析:用铂电极电解CuSO4溶液的化学方程式为2CuSO4+ 2H2O  2Cu + 2H2SO4+ O2↑.在整个闭合回路中电子转移数目相等。所以n(Cu)=12.8g÷64g/mol=0.2mol.n(e-)=0.4mol。所以n(O2)=0.1mol.在标准状况下其体积为2.24L。选项为D。
2Cu + 2H2SO4+ O2↑.在整个闭合回路中电子转移数目相等。所以n(Cu)=12.8g÷64g/mol=0.2mol.n(e-)=0.4mol。所以n(O2)=0.1mol.在标准状况下其体积为2.24L。选项为D。
本题难度:一般