时间:2017-08-06 10:02:34
1、选择题 NH3.H2S等是极性键构成的极性分子,CO2.BF3.CCl4等是极性键构成的非极性分子。根据上述事实,通过比较归纳可推出ABn型分子是非极性分子的经验规律是
[? ]
A.分子中不含有H原子的分子是非极性分子
B.在ABn分子中A原子的所有价电子都参与成键的是非极性分子
C.ABn分子中每个共价键的键长都相等的分子是非极性分子
D.在ABn分子中A的相对原子质量小于B的相对原子质量时为非极性分子
参考答案:B
本题解析:
本题难度:一般
2、填空题 长期以来一直认为氟的含氧酸不存在.但是至1971年斯图杰尔和阿佩里曼(美)成功地合成了次氟酸后,这种论点被剧烈地动摇了.他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸.
(1)以下两种结构式,能正确表示次氟酸结构的是______.A、H-O-F?B、H-F-O
(2)次氟酸中氧元素的化合价为______,次氟酸的电子式为______,次氟酸分子中共价键的键角______180°(填“<”或“=”).
(3)下面给出了几个分子和基团化学键的键能:
H2
O2
F2
OH
OF
HF
E/(kJ/mol)
432
494
155
424
220
566
请计算反应 2HOF(g)=2HF(g)+O2(g)的反应热(△H),近似为______kJ/mol.从计算结果预测次氟酸的一条化学性质:______.
(4)次氟酸能被热水瞬间分解,生成一种常见的物质M,M是18e-,且被称为“绿色氧化剂”.写出次氟酸与热水反应的化学方程式:______.
参考答案:(1)因HFO为共价化合物,根据共价键成键的特点,氢原子形成一对共用电子对,氧原子形成两对共用电子对,氟原子形成一对共用电子对,其结构式为H-O-F,故答案为:A;
(2)因为F元素吸引电子对的能力比O元素强,在次氟酸中F元素呈-1价,H元素为+1价,则O元素呈零价,次氟酸的电子式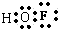
,次氟酸中心原子是氧,采用sp3杂化,分子中共价键的键角<180°,
故答案为:0;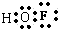
;<;
(3)反应热=反应物的总键能-生成物的总键能=424KJ/mol×2+220 KJ/mol×2-566KJ/mol×2-494KJ/mol=-338KJ/mol,次氟酸分解放出大量的热,故有强氧化性,故答案为:-338;具有强氧化性;
(4)被称为“绿色氧化剂”的过氧化氢(H2O2),次氟酸与热水反应的化学方程式:HOF+H2O=△=HF+H2O2,
故答案为:HOF+H2O=△=HF+H2O2;
本题解析:
本题难度:一般
3、选择题 已知[Co(NH3)6]3+呈正八面体结构,若其中有两个NH3分子分别被Cl-和H2O取代,所形成的[Co(NH3)2Cl2(H2O)2]3+的几何异构体种数有(不考虑光学异构)几种(? )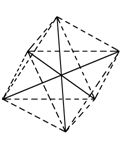
A.3种
B.4种
C.5种
D.6种
参考答案:C
本题解析:[Co(NH3)6]3+呈正八面体结构,有六个顶点,四个NH3分子呈正方形,Co原子在正方形中心,另外两个NH3分子分别在正方形正上方和正下方,组成正八面体。
两个NH3分子分别被Cl-和H2O取代,形成[Co(NH3)2Cl2(H2O)2]3+,六个顶点,有三种基团,设为ABC,第一类是相同基团以Co原子为对称中心,不考虑光学异构,只有一种;第二类,以第一种为原型上下顶点不变,只改变正方形,只有一种变化,即原来正方形中的相同基团相邻了,因为有三种基团,所以该类有三种几何异构体;第三类,所有相同的基团都相邻,不考虑光学异构,也只有一种异构体。综上所述,共有5种几何异构体。
点评:考查同分异构体书写。
本题难度:简单
4、选择题 通常状况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是
A.CCl4中C—C1键键长比NC13中N—C1键键长短
B.NCl3分子中四个原子共平面
C.分子中的所有原子均达到8电子稳定结构
D.NBr3比NCl3易挥发
参考答案:C
本题解析:A错,CCl4中C—C1键键长比NC13中N—C1键键长长;B错,由于氨分子空间结构为三角锥形,所以,NCl3分子中四个原子不可能共平面;C正确;D错,对于组成和结构相似的物质,相对分子质量越大物质的沸点越高。
本题难度:简单
5、填空题 【物质结构与性质】
X、Y、Z、W是原子序数依次增大的前四周期元素,已知:
①X元素原子的最外层电子数是次外层的2倍;
②Y元素原子的p轨道上有2个未成对电子;
③Z元素在同一短周期元素中的原子半径最大;
④W元素原子的最外层电子数与Z相同,其余各电子层均充满电子。
请回答下列问题:
(1)X、Y、Z三种元素的第一电离能从小到大的顺序是?(用元素符号表示,下同);
(2)W元素原子核外电子排布式是?;
(3)Z元素与氢元素形成的化合物熔点比Y元素的氢化物熔点高,原因是?;
(4)X的一种氢化物相对分子质量为42,分子中含有σ键和π键的个数比为8︰1,则该分子中X原子的杂化类型是?和?。
(5)Y的最简单氢化物可以和W2+形成配位键,而X的最简单氢化物则不行,其原因是?。
参考答案:(1)Na<C<O?(2分)
(2)1s22s22p63s23p63d104s1?(2分)
(3)NaH是离子晶体,熔化时破坏离子键,H2O是分子晶体,熔化时破坏分子间作用力,破坏离子键比破坏分子间作用力所需的能量大?(2分)
(4)sp2、 sp3?(各1分,共2分)
(5)H2O中的O原子中存在孤电子对,而CH4中的C原子没有孤电子对(2分)
本题解析:略
本题难度:一般