时间:2017-08-06 09:49:26
1、选择题 下列溶液中微粒浓度关系一定正确的是
A.室温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+)
B.pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+)
C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)> c(OH-)
D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
参考答案:AC
本题解析:试题分析:氨水和氯化铵混合溶液中含有NH4+、H+、OH-、Cl-,溶液呈电中性,根据电荷守恒原理,则c(Cl-)+c(OH-)=c(H+)+c(NH4+),pH=7的混合溶液中c(OH-)=c(H+),则该溶液中c(Cl-)=c(NH4+),故A错误;pH=1的一元强酸溶液和pH=13的一元强碱溶液等体积混合所得溶液呈中性,pH=1的一元强酸溶液和pH=13的一元弱碱溶液等体积混合所得溶液呈碱性,pH=1的一元弱酸溶液和pH=13的一元强碱溶液等体积混合所得溶液呈酸性,酸碱的类型未确定,混合溶液可能显酸性、中性、碱性,故B错误;电离程度:(NH4)2SO4>H2O,即(NH4)2SO4=2NH4++SO42-、H2O H++OH-,硫酸根不能水解,铵根离子水解程度很弱,少部分铵根离子与水电离出的氢氧根离子结合生成一水合氨,使水的电离平衡向电离方向移动,则溶液中c(NH4+)>c(SO42-)>c(H+)> c(OH-),故C正确;电离程度:Na2S>H2O,即Na2S=2Na++ S2-、H2O
H++OH-,硫酸根不能水解,铵根离子水解程度很弱,少部分铵根离子与水电离出的氢氧根离子结合生成一水合氨,使水的电离平衡向电离方向移动,则溶液中c(NH4+)>c(SO42-)>c(H+)> c(OH-),故C正确;电离程度:Na2S>H2O,即Na2S=2Na++ S2-、H2O H++OH-,钠离子不能水解,部分硫离子能水解,其中一部分与水电离出的氢离子结合生成氢硫酸根离子,另一部分与水电离出的氢离子结合生成氢硫酸分子,水电离出的氢氧根离子未被消耗,部分氢离子被消耗,其中一部分被硫离子消耗生成氢硫酸根离子,另一部分被硫离子消耗生成氢硫酸,即H++S2-=HS-、2H++S2-=H2S,根据反应式中各物质的系数之比等于物质的量之比,则前者被消耗的氢离子浓度等于生成的氢硫酸根离子浓度,后者被消耗的氢离子浓度等于生成的氢硫酸分子浓度的2倍,由于水电离出的氢氧根离子浓度等于氢离子的总浓度,氢离子的总浓度等于未被消耗氢离子浓度、生成的氢硫酸根离子浓度和氢硫酸分子浓度的2倍之和,则该溶液中c(OH-)=c(H+)+c(HS-)+2c(H2S),不能违反质子守恒原理,故D错误。
H++OH-,钠离子不能水解,部分硫离子能水解,其中一部分与水电离出的氢离子结合生成氢硫酸根离子,另一部分与水电离出的氢离子结合生成氢硫酸分子,水电离出的氢氧根离子未被消耗,部分氢离子被消耗,其中一部分被硫离子消耗生成氢硫酸根离子,另一部分被硫离子消耗生成氢硫酸,即H++S2-=HS-、2H++S2-=H2S,根据反应式中各物质的系数之比等于物质的量之比,则前者被消耗的氢离子浓度等于生成的氢硫酸根离子浓度,后者被消耗的氢离子浓度等于生成的氢硫酸分子浓度的2倍,由于水电离出的氢氧根离子浓度等于氢离子的总浓度,氢离子的总浓度等于未被消耗氢离子浓度、生成的氢硫酸根离子浓度和氢硫酸分子浓度的2倍之和,则该溶液中c(OH-)=c(H+)+c(HS-)+2c(H2S),不能违反质子守恒原理,故D错误。
考点:考查电解质溶液中粒子浓度大小关系,涉及溶液的酸碱性及pH、电荷守恒原理及关系式、强电解质、弱电解质、盐类水解、酸碱等体积混合溶液的酸碱性、 91eXaM.org硫化钠溶液中的质子守恒原理及关系式等。
本题难度:简单
2、选择题 常温下,0.1mol/L HX的pH=1,0.1 mol/LCH3COOH的pH=2.9。下列说法中不正确的是
A.HX和CH3COOH均可抑制水的电离
B.将HCl与HX各0.1mol溶于水配成1L混合溶液,则溶液的c(H+)="0.2" mol/L
C.等物质的量浓度等体积的HX与CH3COONa两溶液混合后所得溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.向等浓度等体积的HX和CH3COOH溶液中,分别加入同浓度的NaOH溶液,欲使两者pH均等于7,则消耗氢氧化钠溶液的体积前者大于后者
参考答案:B
本题解析:试题分析:B、由题干信息0.1mol/L HX的pH=1,0.1 mol/LCH3COOH的pH=2.9可知前者是强酸,后者是弱酸,将HCl与HX各0.1mol溶于水配成1L混合溶液,则溶液的c(H+)="0.2" mol/L,由于后者不能完全电离所以c(H+)小于0.2 mol/L
考点:考查弱电解质的电离平衡和溶液中离子浓度的大小判断。
本题难度:简单
3、选择题 常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1醋酸溶液,所得滴定曲线如下图所示。下列说法正确的是?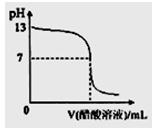
A.pH=7时,所加醋酸溶液的体积为10mL
B.pH<7时,溶液中:c(CH3COO-)>c(Na+)
C.7
D.继续滴加0.1 mol·L-1醋酸溶液,溶液pH可以变为1
参考答案:B
本题解析:当NaOH溶液和醋酸恰好完全反应时,生成醋酸钠水解而使溶液显碱性,故A错。当pH<7时有c(H+)>c(OH-),根据电荷守恒可得c(CH3COO-)>c(Na+),故B正确。当7<pH<13时,溶液也有c(Na+)> c(OH-)> c(CH3COO-)>c(H+)这一种情况,C错。对于选项D可作一极端设想,若溶液就是0.1 mol·L-1醋酸,由于醋酸是弱酸,溶液的pH也大于1,故D也错。
本题难度:一般
4、选择题 胶体微粒具有较强的吸附能力,是因为
A.带有相同电性的电荷
B.有很大的表面积
C.有很强的分散力
D.有电泳现象
参考答案:B
本题解析:
本题难度:困难
5、选择题 在pH都等于4的HCl和NH4Cl两种溶液中,设由水电离产生的H+ 离子浓度分别为A mol/L与B mol/L,则A和B关系为
A.A>B
B.A=10-6 B
C.B=10-6 A
D.A=B
参考答案:B
本题解析:试题分析:pH=4的HCl溶液,由水电离出的c(H+)为10-10,pH=4的NH4Cl溶液,由水电离出的c(H+)为10-4,所以A=10-6 B,答案选B。
考点:水的电离
点评:盐溶液中盐不能电离出H+,所以盐溶液中的H+都是水电离出来的。
本题难度:一般